
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
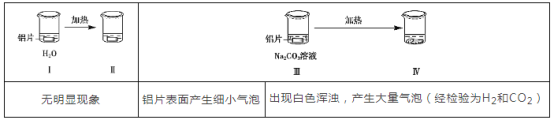
下列说法不正确的是( )
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C. Ⅳ溶液中可能存在大量Al3+
D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
科目:高中化学 来源: 题型:
【题目】(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是_______(填字母代号)。

(2)P4S3可用于制造火柴,其分子结构如图所示。
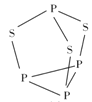
①P4S3分子中硫原子的杂化轨道类型为_______________。
②每个P4S3分子中含有的孤电子对的数目为__________________。
(3)科学家合成了一种阳离子“N5n+,其结构是对称的,5个N排成"V"形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”的化学式为”N8”的离子晶体,其电子式为_________________。分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满是8电子稳定结构,其结构式为_____。
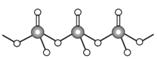
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为_________________。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径
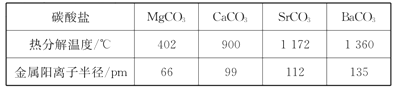
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是_______________。
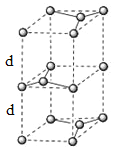
(6)石墨的晶体结构和晶胞结构如下图所示。已知石墨的密度为pgcm3,C—C键的键长为![]() cm,阿伏加德罗常数的值为NA,则石墨品体的层间距为_________cm。
cm,阿伏加德罗常数的值为NA,则石墨品体的层间距为_________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入1 mol·L-1的H2SO4溶液中,乙同学将电极放入1mol·L-1的NaOH溶液中,如图所示。

①写出甲中负极的电极反应式:__________。
②乙中负极反应式为__________,总反应的离子方程式:_______。
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CH3OH(甲醇)和O2 ,则发生了原电池反应,该原电池中的负极反应式为________________;正极反应式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是一种重要的化工原料,可通过丁烯催化裂解或丁烯与甲醇耦合制备。
Ⅰ.丁烯催化裂解生产丙烯的反应方程式是2C4H8(g)![]() 2C3H6(g)+ C2H4(g)。
2C3H6(g)+ C2H4(g)。
(1)已知C4H8、C3H6、C2H4的燃烧热分别为2710.0 kJ![]() mol-1、2050.0 kJ
mol-1、2050.0 kJ![]() mol-1、1410.0 kJ
mol-1、1410.0 kJ![]() mol-1,则该反应的ΔH=_______ kJ
mol-1,则该反应的ΔH=_______ kJ![]() mol-1。下列操作既能提高C4H8的平衡转化率,又能加快反应速率的是_________。
mol-1。下列操作既能提高C4H8的平衡转化率,又能加快反应速率的是_________。
A.升高温度 B.增大压强
C.增大C4H8的浓度 D.使用更高效的催化剂
(2)某温度下,在体积为2 L的刚性密闭容器中充入2.00 mol C4H8进行上述反应,容器内的总压强p随时间t的变化如下表所示:
反应时间t/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
总压强p/kPa | 4.00 | 4.51 | 4.80 | 4.91 | 4.96 | 5.00 | 5.00 |
则0~10 min内υ(C4H8)=_______ mol![]() L-1
L-1![]() min-1,该温度下的平衡常数K=_______kPa(用气体的分压表示)。
min-1,该温度下的平衡常数K=_______kPa(用气体的分压表示)。
Ⅱ.将甲醇转化耦合到丁烯裂解过程中生产丙烯,主要涉及下列反应:
① 2C4H8(g)![]() 2C3H6(g)+ 2H4(g) ΔH>0
2C3H6(g)+ 2H4(g) ΔH>0
② 2CH3OH(g)![]() C2H4(g) + 2H2O(g) ΔH<0
C2H4(g) + 2H2O(g) ΔH<0
③ C2H4(g)+ C4H8(g)![]() 2C3H6(g) ΔH<0
2C3H6(g) ΔH<0
已知:甲醇吸附在催化剂上,可以活化催化剂;甲醇浓度过大也会抑制丁烯在催化剂上的转化。
(3)图1是C3H6及某些副产物的产率与n(CH3OH)/n(C4H8)的关系曲线。最佳的n(CH3OH)/n(C4H8)约为_________。

(4)图2是某压强下,将CH3OH和C4H8按一定的物质的量之比投料,反应达到平衡时C3H6的体积分数随温度的变化曲线。由图可知平衡时C3H6的体积分数随温度的升高呈现先升高后降低,其原因可能是__________________________________________________。

(5)下列有关将甲醇转化耦合到丁烯裂解过程中生产丙烯的说法正确的是________。
A.增大甲醇的通入量一定可以促进丁烯裂解
B.甲醇转化生成的水可以减少催化剂上的积碳,延长催化剂的寿命
C.提高甲醇与丁烯的物质的量的比值不能提高丙烯的平衡组成
D.将甲醇转化引入丁烯的裂解中,可以实现反应热效应平衡,降低能耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJmol-1表示。请认真观察图1,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。

(2)已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol 碘反应生成HI会________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,是将________转化为________。
(3)某实验小组同学进行如图2的实验,以探究化学反应中的能量变化。实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是________(填“吸热”或“放热”)反应;实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,该反应是________(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应。常温下,金属D单质投入水中能与水剧烈反应。常温下E单质是常见的气体。请按要求回答下列几个问题:
(1)B、D的元素名称分别为:________、________。
(2)E在周期表中的位置为:________。
(3)C离子的结构示意图为:________。
(4)B、C、D三种元素的原子半径从大到小的顺序为________(用元素符号表示)。
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:________(用对应的化学式表示)。
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,0.2mol NH3与_________________g H2O的电子数相等。
(2)含有相同氧原子数的CO和CO2,其质量比为_________________________。
(3)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的摩尔质量__________。
(4)已知V mLAl2(SO4)3溶液中含Al3+ a g,则溶液中SO42-的物质的量浓度是_____________。
(5)下列8种化学符号:11H2、12H2、614C、36Li、1123Na、714N、37Li、1224Mg。
①表示核素的符号共________种。
②互为同位素的是________。
③中子数相等,但质子数不相等的核素是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol/L,含硝酸的浓度为1mol/L,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为
A.89.6mLB.112mLC.168mLD.224mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com