
ĒāäåĖįŌŚŅ½Ņ©ŗĶŹÆ»Æ¹¤ŅµÉĻÓŠ¹ć·ŗÓĆĶ¾”£ĻĀĶ¼ŹĒÄ£Äā¹¤ŅµÖʱøĒāäåĖį“ÖĘ·¼°¾«ÖʵÄĮ÷³Ģ£ŗ
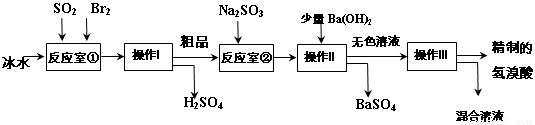
ŅŃÖŖ£ŗBr2ŹĒŅ×»Ó·¢”¢Éīŗģ×ŲÉ«µÄŅŗĢ壻ĒāäåĖįŹĒŅ×»Ó·¢”¢ĪŽÉ«ŅŗĢ唣
øł¾ŻÉĻŹöĮ÷³Ģ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©·“Ó¦ŹŅ¢ŁÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø2£©·“Ó¦ŹŅ¢ŁŹ¹ÓƱłĖ®µÄÄæµÄ ”£
£Ø3£©²Ł×÷IµÄĆū³Ę £¬²Ł×÷¢ņÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠ ”£
£Ø4£©·“Ó¦ŹŅ¢ŚÖŠ¼ÓČėNa2SO3µÄÄæµÄŹĒ ”£
£Ø5£©¹¤ŅµÉś²śÖŠÖʵƵÄĒāäåĖį“ųÓŠµµµÄ»ĘÉ«”£ÓŚŹĒ¼×ŅŅĮ½Ķ¬Ń§Éč¼ĘĮĖŹµŃé¼ÓŅŌĢ½¾æ£ŗ
¢Ł¼×Ķ¬Ń§¼ŁÉč¹¤ŅµĒāäåĖį³Źµ»ĘÉ«ŹĒŅņĪŖŗ¬Fe3£«£¬ŌņÓĆÓŚÖ¤Ć÷øĆ¼ŁÉčĖłÓƵďŌ¼ĮĪŖ £¬Čō¼ŁÉč³ÉĮ¢æɹŪ²ģµ½µÄĻÖĻóĪŖ ”£
¢ŚŅŅĶ¬Ń§¼ŁÉč¹¤ŅµĒāäåĖį³Źµ»ĘÉ«ŹĒŅņĪŖ £¬ĘäÓĆÓŚÖ¤Ć÷øĆ¼ŁÉč³ÉĮ¢µÄ·½·ØĪŖ ”£
£Ø1£©SO2+Br2+2H2O=H2SO4+2HBr £Ø2£©·ĄÖ¹Br2ŗĶHBr»Ó·¢
£Ø3£©ÕōĮó£»Ā©¶·”¢²£Į§°ō”¢ÉÕ±”£ £Ø4£©»¹Ō“ÖĘ·ÖŠµÄBr2
£Ø5£©¢ŁKSCNČÜŅŗ£¬ĒāäåĖįÓöKSCNČÜŅŗ±äŗģÉ«£»¢ŚĒāäåĖįÖŠŗ¬ÓŠBr2£¬ÓĆ²£Į§°ōÕŗČ”ÖʵƵÄĒāäåĖį£¬µćŌŚŹŖČóµķ·ŪKIŹŌÖ½ÉĻ±äĄ¶£Ø»ņÓĆ½ŗĶ·µĪ¹ÜČ”ÖʵƵÄĒāäåĖįÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓCCl4”¢Õńµ“”¢¾²Ö¹£¬ĻĀ²ć³Ź³ČŗģÉ«£©£¬Ö¤Ć÷Ņņŗ¬Br2¶ųĻŌ»ĘÉ«”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©·“Ó¦ŹŅ¢ŁÖŠSO2ŗĶBr2ŌŚ±łĖ®ÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖSO2+Br2+2H2O=H2SO4+2HBr”££Ø2£©·“Ó¦ŹŅ¢ŁŹ¹ÓƱłĖ®µÄÄæµÄŹĒĪŖĮĖ·ĄÖ¹Br2ŗĶHBr»Ó·¢¶ųĪŪČ¾æÕĘų£¬Ó°Ļģ²Ł×÷”££Ø3£©²Ł×÷IŹĒ·ÖĄė»„ČܵķŠµć²»Ķ¬µÄŅŗĢåĪļÖŹµÄ²Ł×÷”£Ćū³ĘŹĒÕōĮ󔣲Ł×÷¢ņÓƵ½µÄ²£Į§ŅĒĘ÷ÓŠĀ©¶·”¢²£Į§°ō”¢ÉÕ±”££Ø4£©·“Ó¦ŹŅ¢ŚÖŠ¼ÓČėNa2SO3µÄÄæµÄŹĒĪŖĮĖĻūŗÄĪŖ·“Ó¦µÄBr2£¬ĢįøßĪļÖŹµÄ“æ¶Č”££Ø5£©¹¤ŅµÉś²śÖŠÖʵƵÄĒāäåĖį“ųÓŠµµµÄ»ĘÉ«”£¢Ł¼×Ķ¬Ń§¼ŁÉč¹¤ŅµĒāäåĖį³Źµ»ĘÉ«ŹĒŅņĪŖŗ¬Fe3£«”£¼ģŃéµÄ·½·ØŹĒȔɣĮæµÄČÜŅŗ£¬ĻņĘäÖŠµĪ¼Ó¼øµĪKSCNČÜŅŗ£¬Čō¹¤ŅµĒāäåĖįÓöKSCNČÜŅŗ±äŗģÉ«£»¾ĶÖ¤Ć÷ŗ¬ÓŠFe3£«£»·ńŌņ¾Ķ°Éŗ¬ÓŠFe3£«”£¢ŚŅŅĶ¬Ń§¼ŁÉč¹¤ŅµĒāäåĖį³Źµ»ĘÉ«ŹĒŅņĪŖŗ¬ÓŠBr2”£¼ģŃéµÄ·½·ØŹĒĄūÓĆĘäĒæŃõ»ÆŠŌ”£ÓĆ²£Į§°ōÕŗČ”ÖʵƵÄĒāäåĖį£¬µćŌŚŹŖČóµķ·ŪKIŹŌÖ½ÉĻ±äĄ¶£ØŅ²æÉŅŌĄūÓĆĘäŌŚÓŠ»śČܼĮÖŠµÄČܽā¶Č“óµÄŠŌÖŹ”£ÓĆ½ŗĶ·µĪ¹ÜČ”ÖʵƵÄĒāäåĖįÓŚŹŌ¹ÜÖŠ£¬µĪ¼ÓCCl4”¢Õńµ“”¢¾²Ö¹£¬ĻĀ²ć³Ź³ČŗģÉ«£©£¬Ö¤Ć÷Ņņŗ¬Br2¶ųĻŌ»ĘÉ«”£
æ¼µć£ŗæ¼²éSO2ŗĶBr2µÄŠŌÖŹ”¢»ģŗĻĪļµÄ·ÖĄė·½·Ø”¢²Ł×÷”¢Fe3£«ŗĶBr2µÄ¼ģŃé·½·ØµÄÖŖŹ¶”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014Ń§ÄźÉ½¶«Ź”Ōę×ÆŹŠøßČżĻĀѧʌµŚ¶ž“ĪÄ£Äāæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĄė×Ó·½³ĢŹ½ÕżČ·µÄŹĒ( )
A£®Na2S2O3ČÜŅŗÖŠ¼ÓČėĻ”ŃĪĖį£ŗ2S2O32££«2H£«=SO42££«3S”ż£«H2O
B£®“ÅŠŌŃõ»ÆĢśČÜÓŚĻ”ĻõĖį£ŗ3Fe3O4£«28H£«£«NO3£ 9Fe3£«£«NO”ü£«14H2O
9Fe3£«£«NO”ü£«14H2O
C£®100ml0.1mol/L FeI2ČÜŅŗÓė±źæöĻĀ0.224L Cl2: 2Fe2++ Cl2=2Fe3++2Cl-
D£®ĻņĆ÷·ÆČÜŅŗÖŠµĪ¼ÓBa(OH)2ČÜŅŗ£¬Ē”ŗĆŹ¹SO42-³ĮµķĶźČ«£ŗ2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3”ż+3BaSO4”ż
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğĢģ½ņŹŠĘߊ£øßČż4ŌĀĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
æÕ¼äŹµŃéŹŅ”°Ģģ¹¬Ņ»ŗÅ”±µÄ¹©µēĻµĶ³ÖŠÓŠŌŁÉśĒāŃõČ¼ĮĻµē³Ų£ØRFC£©£¬RFCŹĒŅ»ÖÖ½«Ė®µē½ā¼¼ŹõÓėĒāŃõČ¼ĮĻµē³Ų¼¼ŹõĻą½įŗĻµÄæɳä·Åµē³Ų”£ĻĀĶ¼ĪŖRFC¹¤×÷ŌĄķŹ¾ŅāĶ¼£¬ÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£ŗ£Ø £©
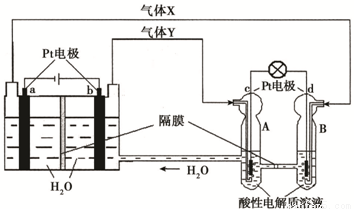
A£®µ±ÓŠ0.1 molµē×Ó×ŖŅĘŹ±£¬a¼«²śÉś±ź×¼×“æöĻĀ1.12 L H2
B£®×ó¶Ė×°ÖĆÖŠ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ£¬ÓŅ¶Ė×°ÖĆÖŠµēÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ
C£®c¼«ÉĻ·¢ÉśµÄµē¼«·“Ó¦ŹĒ£ŗO2 + 2H2O + 4e- £½ 4OH”Ŗ
D£®d¼«ÉĻ½ųŠŠ»¹Ō·“Ó¦£¬ÓŅ¶Ė×°ÖĆBÖŠµÄH+æÉŅŌĶعżøōĤ½ųČėA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğ±±¾©ŹŠĶØÖŻĒųøßȿğ¼¶Ä£Äāæ¼ŹŌ£ØŅ»£©Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŹµŃéĢā
½ŚČÕĘŚ¼äŅņČ¼·Å±ŽÅŚ»įŅżĘšæÕĘųÖŠSO2ŗ¬ĮæŌöøߣ¬Ōģ³É“óĘųĪŪČ¾”£Ä³ŹµŃ銔×éĶ¬Ń§ÓūĢ½¾æSO2µÄŠŌÖŹ£¬²¢²ā¶ØæÕĘųÖŠSO2µÄŗ¬Į攣
£Ø1£©ĖūĆĒÉč¼ĘČēĻĀŹµŃé×°ÖĆ£¬ĒėÄć²ĪÓėĢ½¾æ£¬²¢»Ų“šĪŹĢā£ŗ
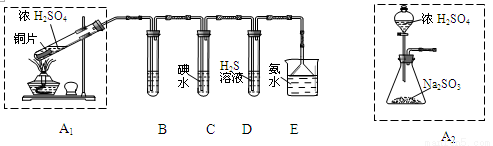
¢Ł×°ÖĆA1ÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £»
¢Ś×°ÖĆBÓĆÓŚ¼ģŃéSO2µÄĘư׊Ō£¬ĘäÖŠĖłŹ¢ŹŌ¼ĮĪŖ £¬×°ÖĆDÓĆÓŚ¼ģŃéSO2µÄ ŠŌÖŹ£»
¢Ū×°ÖĆCÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ £»
¢ÜĪŖĮĖŹµĻÖĀĢÉ«»·±£µÄÄæ±ź£¬¼×Ķ¬Ń§ÓūÓĆ×°ÖĆA2“śĢę×°ÖĆA1£¬ÄćČĻĪŖ×°ÖĆA2µÄÓŵćŹĒ£ØŠ“¶žµć£© ”¢ £»
£Ø2£©ĖūĆĒÄāÓĆŅŌĻĀ·½·Ø²ā¶ØæÕĘųÖŠSO2ŗ¬Įæ£Ø¼ŁÉčæÕĘųÖŠĪŽĘäĖū»¹ŌŠŌĘųĢ壩”£
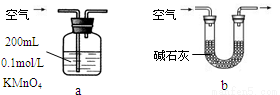
¢ŁÄćČĻĪŖÄÄøö×°ÖĆæÉŠŠ£ØĢīŠņŗÅ£© £¬Ź¹ÓĆÄćĖłŃ”ÓƵÄ×°ÖĆ²ā¶ØSO2ŗ¬ĮæŹ±£¬»¹ŠčŅŖ²ā¶ØµÄĪļĄķĮæŹĒ £»
¢ŚÄćČĻĪŖÄÄøö×°ÖĆ²»æÉŠŠ£ØĢīŠņŗÅ£© £¬ĖµĆ÷ĄķÓÉ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğ±±¾©ŹŠĶØÖŻĒųøßȿğ¼¶Ä£Äāæ¼ŹŌ£ØŅ»£©Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
Ģį“æĻĀĮŠĪļÖŹĖłŃ”ŹŌ¼Į¼°¶ŌÓ¦·ÖĄė·½·Ø¾łæÉŠŠµÄŹĒ
| Īļ ÖŹ | ŌÓ ÖŹ | Ėł Ń” ŹŌ ¼Į | ·½ ·Ø |
A | ŅŅĶé | ŅŅĻ© | ĖįŠŌKMnO4ČÜŅŗ | Ļ“Ęų |
B | äå±½ | äå | H2O | ŻĶČ” |
C | ŅŅĖį | ±½·Ó | NaOHČÜŅŗ | ÕōĮó |
D | ŅŅĖįŅŅõ„ | ŅŅĖį | ±„ŗĶNa2CO3ČÜŅŗ | ·ÖŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğ±±¾©ŹŠ·æɽĒųøßČżŅ»Ä£Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŗ¬µŖ·ĻĖ®ÖŠµÄNH4£«ŌŚŅ»¶ØĢõ¼žĻĀæÉÓėO2·¢ÉśŅŌĻĀ·“Ó¦£ŗ
¢Ł NH4£«(aq) + 3/2O2(g) = NO2£(aq) + 2H£«(aq) + H2O(l) ¦¤H = -273kL/mol
¢Ś NO2£(aq) + 1/2O2(g) = NO3£(aq) ¦¤H = -73kL/mol
ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
A£®ÉżøßĪĀ¶Č£¬æÉŹ¹¢Ł¢Ś·“Ó¦ĖŁĀŹ¾ł¼Óæģ
B£®ŹŅĪĀĻĀŹ±0.1 mol/L HNO2(aq) pH£¾1£¬ŌņNaNO2ČÜŅŗĻŌ¼īŠŌ
C£®NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l) ¦¤H = -346kJ/mol
D£®1 mol NH4£«ŌŚ¢Ł·“Ó¦ÖŠÓė1 mol NO2£ŌŚ¢Ś·“Ó¦ÖŠŹ§µē×ÓŹżÖ®±ČĪŖ1:3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğ±±¾©ŹŠ·įĢØĒųøßČżĻĀѧʌĶ³Ņ»Į·Ļ°£ØŅ»£©»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ĒŠæŖµÄ½šŹōNa±©Ā¶ŌŚæÕĘųÖŠ£¬Ęä±ä»Æ¹ż³ĢČēĻĀ£ŗ

£Ø1£©·“Ó¦¢ńµÄ·“Ó¦¹ż³ĢÓėÄÜĮæ±ä»ÆµÄ¹ŲĻµČēĻĀ£ŗ
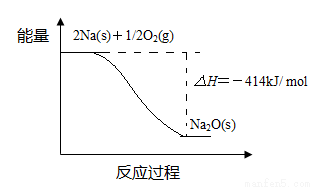
¢Ł ·“Ó¦¢ń ŹĒ”” ””·“Ó¦£ØĢī”°·ÅČČ”±»ņ”°ĪüČČ”±£©£¬ÅŠ¶ĻŅĄ¾ŻŹĒ”””””””£
¢Ś 1 mol Na(s)Č«²æŃõ»Æ³ÉNa2O(s)µÄČČ»Æѧ·½³ĢŹ½ŹĒ”””””””£
£Ø2£©·“Ó¦¢ņŹĒNa2OÓėĖ®µÄ·“Ó¦£¬Ęä²śĪļµÄµē×ÓŹ½ŹĒ ”£
£Ø3£©°×É«·ŪÄ©ĪŖNa2CO3”£½«ĘäČÜÓŚĖ®ÅäÖĘĪŖ0.1 mol/L Na2CO3ČÜŅŗ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £ØĢī×ÖÄø£©”£
A£®ÉżøßĪĀ¶Č£¬ČÜŅŗµÄpH½µµĶ
B£®c(OH£)£c (H£«)£½c (HCO3£)£«2 c (H2CO3)
C£®¼ÓČėÉŁĮæNaOH¹ĢĢ壬c (CO32ØD)Óėc (Na£«)¾łŌö“ó
D£®c (Na£«) > c (CO32ØD) > c (HCO3ØD) > c(OHØD) > c (H£«)
£Ø4£© Äʵē³ŲµÄŃŠ¾ææŖ·¢ŌŚŅ»¶Ø³Ģ¶ČÉĻæÉ»ŗŗĶŅņļ®×ŹŌ“¶ĢȱŅż·¢µÄµē³Ų·¢Õ¹ŹÜĻŽĪŹĢā”£
¢Ł ÄʱČļ®»īĘĆ£¬ÓĆŌ×Ó½į¹¹½āŹĶŌŅņ_______”£
¢Ś ZEBRA µē³ŲŹĒŅ»ÖÖÄʵē³Ų£¬×Ü·“Ó¦ĪŖNiCl2 + 2Na  Ni + 2NaCl”£ĘäÕż¼«·“Ó¦Ź½ŹĒ_____”£
Ni + 2NaCl”£ĘäÕż¼«·“Ó¦Ź½ŹĒ_____”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğÉĻŗ£ŹŠćÉŠŠĒųøßČż¶žÄ£»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖŌŚ³£ĪĀĻĀ²āµĆÅØ¶Č¾łĪŖ0.1mol/LµÄĻĀĮŠ6ÖÖČÜŅŗµÄpHÖµ£ŗ
ČÜÖŹ | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
ĻĀĮŠĖµ·Ø»ņ±ķ“ļÖŠ£¬ÕżČ·µÄŹĒ
A£®ÉŁĮ涞Ńõ»ÆĢ¼ĶØČėNaClOČÜŅŗÖŠ£ŗ2NaClO + CO2 + H2O Na2CO3 + 2HClO
Na2CO3 + 2HClO
B£®¹żĮæµÄ HCNµĪČėĢ¼ĖįÄĘČÜŅŗÖŠ HCN + Na2CO3 NaCN+ NaHCO3
NaCN+ NaHCO3
C£®½įŗĻÖŹ×ÓÄÜĮ¦ÓÉĒæµ½ČõµÄĖ³ŠņĪŖ£ŗCO32”Ŗ£¾CN”Ŗ£¾HCO3”Ŗ£¾CH3COO”Ŗ
D£®³£ĪĀĻĀµēĄė³£Źż£ŗKi2(H2CO3)£¾Ki(C6H5OH)£¾Ki(HCN)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013-2014ѧğÉĻŗ£ŹŠŠģ»ć”¢Ėɽ”¢½šÉ½ČżĒųøßČż¶žÄ£»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĪļÖŹ¶¼¾ßÓŠ½ĻĒæµÄĪüĖ®ŠŌ”£ÓūŹ¹Ļ”ĻõĖį³ÉĪŖÅØĻõĖį£¬²»ÄÜŹ¹ÓƵďŌ¼ĮŹĒ
A£®ÅØĮņĖį B£®ĪåŃõ»Æ¶žĮ× C£®ĪŽĖ®ĮņĖįĆ¾ D£®øŹÓĶ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com