
| 序号 | X | Y | Z | W | 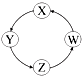 |
| ① | CuO | Cu(OH)2 | CuSO4 | Cu | |
| ② | NaCl | NaHCO3 | Na2CO3 | NaOH | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | SO2 | H2SO3 | Na2SO3 | NaHSO3 |
| A、①②③ | B、①③④ |
| C、②③④ | D、①②④ |


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| A、含有NA个氮气和乙烯分子的混合气体质量为28g |
| B、标准状况下,11.2L氦气中含有NA个氦原子 |
| C、将NA个NH3分子溶于lL水中得到lmol?L-1的氨水 |
| D、100mL 0.1mol?L-1AlCl3溶液含有0.01NA个A13+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

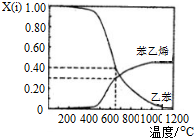
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
c(N
| ||
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中分子数为0.5NA |
| C、7.8gNa2O2固体中阴、阳离子总数为0.3NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ |
| 0.1mol?L-1 CH3COOH 溶液 | pH=12 NaOH溶液 | 0.1mol?L-1 NaOH 溶液 | pH=2 CH3COOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| B、SO2具有漂白性可以是酸性高锰酸钾溶液褪色 |
| C、实验室可用NaOH溶液处理NO2和SO2废气 |
| D、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||||||
| B、汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | ||||||||||
| C、能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | ||||||||||
| D、乳酸分子中既有羟基又有羧基,因此可在一定条件下缩聚得到聚乳酸(PLA).该高分子化合物是一种可降解的环保材料. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加强海底可燃冰、锰结核的探测与开发研究 |
| B、将地沟油回收利用生产生物柴油,变废为宝 |
| C、在生产、流通和消费等过程中实行“减量化、再利用、资源化” |
| D、电镀废液经中和后排放灌溉农田,提高水的利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com