
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
分析 Ⅰ.取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,即为二氧化氮,那么一定含有NO3-和Fe2+;
Ⅱ.向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成,那么溶液中一定含有:SO42-,那么原溶液中一定不含有:Ba2+,生成的沉淀是硫酸钡;
Ⅲ.向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成,不能确定原溶液中是否含有:Fe3+,因为亚铁离子被硝酸氧化生成铁离子;过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成,向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成说明含有Al3+,故不含CO32-和SiO32-,据此解答各小题即可.
解答 解:Ⅰ.取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,即为二氧化氮,那么一定含有NO3-和Fe2+;
Ⅱ.向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成,那么溶液中一定含有:SO42-,那么原溶液中一定不含有:Ba2+,生成的沉淀是硫酸钡;
Ⅲ.向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成,不能确定原溶液中是否含有:Fe3+,因为亚铁离子被硝酸氧化生成铁离子;过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成,向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成说明含有Al3+,故不含CO32-和SiO32-,
(1)依据分析可知:该废水中一定含有的阴离子是:NO3- SO42-; 一定不含有的阳离子是:Ba2+,故答案为:NO3-、SO42-;Ba2+;
(2)偏铝酸根与碳酸生成氢氧化铝沉淀,离子反应方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)在此反应中Al化合价由0价升高为+3价,N元素被还原为氨气和氮气,且体积比为1:4,根据元素守恒得到X应为NO3-;反应前有氢元素,根据元素守恒得到反应后也应该有氢元素,故产物中还有H2O;根据化合价升降相等可以得到此反应.分析本反应中的化合价的变化可以看到氮元素化合价降低即还原产物为NH3 和 N2;根据反应16Al+9NO3-+7OH-=16AlO2-+NH3↑+4N2↑+2H2O
16mol 9mol
n(Al) 0.2mol,n(Al)=16×0.2/9mol,故m(Al)=9.6g,
故答案为:16Al+9NO3-+7OH-=16AlO2-+NH3↑+4N2↑+2H2O;NH3、N2; 9.6g.
点评 本题主要考查的是常见阳离子与阴离子的检验,涉及知识点:氧化还原反应方程式的配平,溶度积常数的计算等,熟练掌握离子共存的条件及离子性质是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq) 中的c[Fe(SCN)2+]温度T的平衡图象.A点与B点相比,A点的c(Fe3+) 大 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③表示电源X极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-=O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.35g | B. | 0.27g | C. | 0.54g | D. | 2.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18y/x | B. | 9y/x | C. | 18y/x mol-1 | D. | 9y/x mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数之差为2的两种元素不可能位于同一主族 | |
| B. | D-核外有36个电子,则元素D位于第四周期第ⅦA族 | |
| C. | 位于同一主族的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4 | |
| D. | 位于同一周期的甲乙两种元素,甲位于第ⅠA族,原子序数为x,乙位于第ⅢA族,则乙原子序数可能为x+19 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
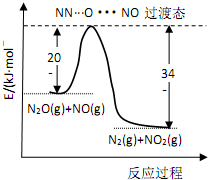 由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )
由 N2O和NO反应生成N2和NO2的能量变化如图所示,下列说法正确的是( )| A. | 由图分析 N2O(g) 的能量一定高于 NO2(g)+N2(g) | |
| B. | 反应过程中没有发生化学键的断裂和化学键的生成 | |
| C. | 若生成 1mol N2(g),其△H=-139kJ•mol-1 | |
| D. | 由图可知 N2+NO2=N2O+NO△H=+139kJ•mol-1, 若使用催化剂还可以减小反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com