
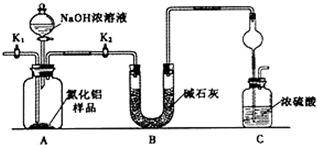
分析 【方案l】测定原理是通过测定A1N+NaOH+H2O=NaAlO2+NH3↑反应生成氨气的质量来计算氮化铝的含量.
(1)AlN溶于强碱溶液时会生成NH3来书写方程式;分析装置和仪器作用分析,氨气是和浓硫酸能发生反应的气体,易发生倒吸,仪器作用是防止倒吸的作用;
(2)组装好实验装置,依据原理可知气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算;
(3)若去掉装置B,测定氨气含量会增大,AlN的含量会增大,计算装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
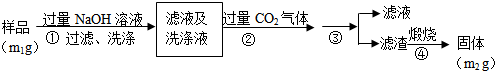
【方案2】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量.
解答 解:【方案1】(1)根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑;
氨气是与浓硫酸能发生反应的气体,易发生倒吸,图C装置中球形干燥管的作用是防止倒吸的作用,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;防止倒吸;
(2)组装好实验装置,气体制备需要先检查装置气密性,加入实验药品.接下来的实验操作是关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,测定C装置反应前后的质量变化.通入氮气的目的是,反应生成氨气后把装置中的气体全部赶入装置C被浓硫酸吸收,准确测定装置C的增重计算,
故答案为:检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置;
(3)若去掉装置B,测定氨气含量会增大,导致AlN的含量测定结果偏高,装置存在缺陷是空气中的水蒸气也可以进入装置C,使测定结果偏高,需要连接一个盛碱石灰干燥管;
故答案为:偏高;C装置出口处连接一个干燥装置;
【方案2】流程分析可知,样品溶解于过量的氢氧化钠溶液中过滤洗涤,得到滤液和洗涤液中通入过量二氧化碳和偏铝酸钠反应生成氢氧化铝沉淀,过滤洗涤得到氢氧化铝固体,煅烧得到氧化铝固体为m2g;
(4)步骤②生成的沉淀是氢氧化铝,是偏铝酸钠溶液中通入过量二氧化碳气体反应生成,反应的离子方程式为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,
故答案为:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓;
(5)上述分析可知步骤③是过滤洗涤得到氢氧化铝沉淀,测定原理是:A1N+NaOH+H2O=NaAlO2+NH3↑,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀:CO2+AlO2-+2H2O=HCO3-+Al(OH)3↓,氢氧化铝灼烧得到氧化铝,通过测定氧化铝得质量来计算氮化铝的质量,Al2O3物质的量=$\frac{{m}_{2}}{102g/mol}$=$\frac{{m}_{2}}{102}$mol,依据氮元素守恒得到样品中氮元素物质的量=n(AlN)=$\frac{{m}_{2}}{102}$mol×2=$\frac{{m}_{2}}{51}$mol,A1N的纯度=$\frac{\frac{{m}_{2}}{52}mol×41g/mol}{{m}_{1}}$×100%=$\frac{41{m}_{2}}{51{m}_{1}}$×100%,
故答案为:过滤、洗涤;$\frac{41{m}_{2}}{51{m}_{1}}$×100%.
点评 本题考查了物质性质的探究实验设计和氮化铝含量的测定,题目难度中等,明确实验目的、实验原理为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻、蚕丝的成分都是纤维素 | |
| B. | 地沟油的主要成分是高级脂肪酸甘油酯.可用于制肥皂 | |
| C. | 石油分馏的目的是为了获得乙烯、丙烯和1,3-丁二稀 | |
| D. | 乙醇,过氧化氢和臭氧可用于消毒.均体现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
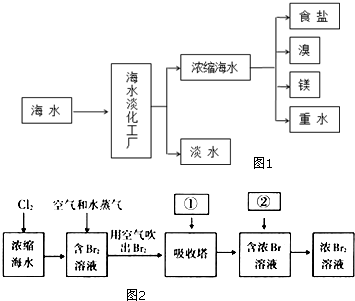 浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,如图1是海水加工的示意图,根据如图回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
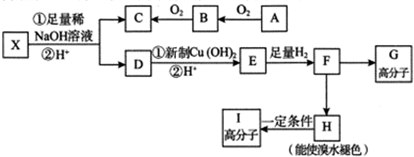
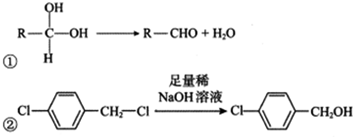
 .
. $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;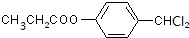 +4NaOH$→_{△}^{水}$CH3CH2COONa+
+4NaOH$→_{△}^{水}$CH3CH2COONa+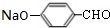 +2H2O+2NaCl;
+2H2O+2NaCl;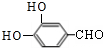 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ S2- CO32- | B. | AlO21 SO42- MnO4- | ||
| C. | NO3- Cl- SO42- | D. | MnO4- SO42- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 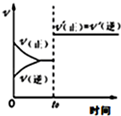 反应CO+NO2?CO2+NO达平衡后,增大压强时反应速率随时间的变化 | |
| B. | 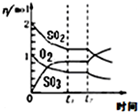 反应2SO2+O2?2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 | |
| C. | 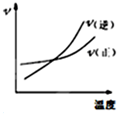 反应N2+3H 2?2NH3△H<0在恒容的容器中,反应速率与温度的关系 | |
| D. | 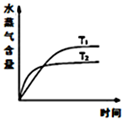 反应CO2(g)+H2(g)?CO(g)+H2O(g)△H>0,温度分别为T 1、T 2时水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
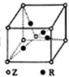 X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:
X、Y、Z、W、R是原子序数依次增大的前四周期元素,这五种元素的相关信息如下:| 元素 | 相关信息 |
| X | 其中一种核素在考古时常用来鉴定一些文物的年代 |
| Y | 原子核外电子有7种不同的运动状态 |
| Z | 地壳中含量最高的元素 |
| W | 价电子排布式为(n+1)sn(n+1)p(n+1) |
| R | 基态原子最外能层只有一个电子,其他能层均已充满电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
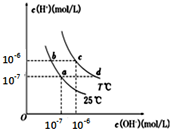
| A. | a点对应的溶液中大量存在:Na+、Mg2+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、Cl-、NO3- | |
| C. | c点对应的溶液中大量存在:K+、Al3+、Cl-、CO32- | |
| D. | d点对应的溶液中大量存在:Na+、NH4+、ClO-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com