
| A、1:2:1 |
| B、2:1:1 |
| C、1:3:2 |
| D、1:1:2 |
| 2.8g |
| 28g/mol |
| 11.2L |
| 22.4L/mol |
| 2.4g |
| 24g/mol |


科目:高中化学 来源: 题型:
| A、上述离子中至少存在6种 |
| B、一定存在Cl-,且c(Cl-)=0.4 mol?L-1 |
| C、一定存在SO42-、NH4+,可能不存在K+ |
| D、一定不存在CO32-、Al3+、K+,一定存在NO3-,且c(NO3- )=0.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N和P是植物营养素,海洋或湖泊中N、P含量越高越有利于水生动植物的生长 |
| B、只要不喝被重金属污染的水就不会中毒,因此水中的重金属污染对人类影响不大 |
| C、用熟石灰处理钢铁厂的酸性废水,利用的是复分解反应原理 |
| D、用Na2S处理含Hg2+废水使Hg2+变成HgS沉淀而除去,利用的是氧化还原反应原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为提高农作物的产量和质量,应大量使用化肥和农药 |
| B、绿色化学的核心是从源头上控制污染 |
| C、实现化石燃料清洁利用,就无需开发新能源 |
| D、垃圾是放错地方的资源,应分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.请观察下列实验装置,分析实验原理,并回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.请观察下列实验装置,分析实验原理,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
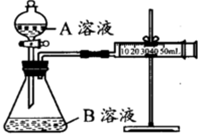 甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响.设计实验方案如下:| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4)(10-4mol/(L?min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| 实验步骤及结论: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com