
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
分析 (1)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子;三种物质都是盐溶液,根据越弱越水解进行判断;
(2)碳酸为弱酸,则碳酸钠溶液水解呈碱性;
(3)由于酸性:HCN>NaHCO3,则NaCN溶液中通入少量二氧化碳生成碳酸氢钠和HCN;
(4)醋酸铵中铵根离子和醋酸根离子的水解程度相同;
(5)弱电解质溶液中,弱电解质的浓度越大,其电离程度越小,浓度越小,其电离程度越大.
解答 解:(1)相同条件下,酸的电离平衡常数越小,其越难电离,其酸根越容易结合氢离子,所以CH3COO-、CN-、CO32-结合质子的能力大小顺序是CO32->CN->CH3COO-;
已知酸性:CH3COOH>H2CO3>HCN,则根据越弱越水解可知,水解程度越大,pH越大,相同条件下,浓度相同的五种溶液的pH由大到小的顺序为②③①,
故答案为:CO32->CN->CH3COO-;②③①;
(2)碳酸为弱酸,碳酸钠溶液水解呈碱性,原因是碳酸根结合水电离出的氢离子,导致溶液中氢离子浓度小于水电离生成氢氧根的浓度,离子反应方程式为:CO32-+H2O?HCO3-+OH-;Na2CO3在溶液中存在:Na2CO3 =2Na++CO32-;CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;H2O?H++OH-;由于盐类的水解程度很小,故离子浓度大小关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:CO32-+H2O?HCO3-+OH-;c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(3)由于酸性:HCN>NaHCO3,则NaCN溶液中通入少量二氧化碳生成碳酸氢钠和HCN,则反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-;
故答案为:CN-+CO2+H2O=HCN+HCO3-;
(4)氨水和醋酸恰好中和时生成醋酸铵,醋酸铵中铵根离子和醋酸根离子的水解程度相同,溶液显中性,则pH=7,故答案为:等于;
(5)一水合氨是弱电解质,在溶液里存在电离平衡,氨水的浓度越大,一水合氨的电离程度越小,浓度越小,一水合氨的电离程度越大,甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,由弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中[OH-]之比小于10,故答案为:小于.
点评 本题考查弱电解质的强弱与水解的关系,并利用电离与水解来分析溶液中的离子的浓度的关系,学生应明确电离平衡常数的应用来解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H5OH在电池的负极上参加反应 | |
| B. | 在外电路中电子由负极沿导线流向正极 | |
| C. | 1mol乙醇被氧化转移6mol电子 | |
| D. | 电解质溶液中阳离子移向正极,阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为FeSO4溶液 | |
| C. | 正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为Ag,负极为Cu,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 基态原子核外三个能级有电子,且每个能级上电子数目相同 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 单质为常见金属,离子半径在同周期中最小 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 有多种化合价,有一种氧化物为黑色磁性晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气中混有二氧化硫(氢氧化钠溶液) | |
| B. | 硫酸亚铁溶液中含有硫酸铜(锌粉) | |
| C. | 二氧化硅中混有石灰石粉末(盐酸) | |
| D. | 二氧化碳中混有二氧化硫(小苏打溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
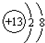 ;
;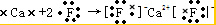 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
| 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积 (mL) | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水可区别Na2CO3和NaHCO3粉末 | |
| B. | 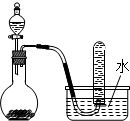 用如图装置进行浓硝酸与铜的反应制取并收集NO2 用如图装置进行浓硝酸与铜的反应制取并收集NO2 | |
| C. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 | |
| D. | 除去粗盐中的Ca2+、Mg2+、SO42-,可依次加入H2O、NaOH、BaCl2、Na2CO3,过滤再加入HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com