
【题目】X、Y、Z、D、E、F是原子序数依次增大的六种常见元素。E的单质在Z2中燃烧的产物可使品红溶液褪色。F和Z元素形成的化合物F3Z4具有磁性。X的单质在Z2中燃烧可生成XZ和XZ2两种气体。D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)F元素在周期表中的位置是________,Y的单质分子的结构式为__________,DZ的电子式为________,DZ化合物中离子半径较大的是________(填离子符号)。
(2)X元素形成的同素异形体的晶体类型可能是________(填序号)。
①原子晶体 ②离子晶体 ③金属晶体 ④分子晶体
(3)X、Y、Z形成的10电子氢化物中,X、Y的氢化物沸点较低的是(写化学式):__________;Y、Z的氢化物分子结合H+能力较强的是(写化学式)________。
(4)下列可作为比较D和Na金属性强弱的依据是________。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)Y的氢化物和Z的单质在一定条件下反应生成Z的氢化物(产物之一),该反应的方程式为___________。
(6)有人建议将氢元素排在元素周期表的ⅣA族,请你从化合价的角度给出一个理由__________。
【答案】 第4周期VIII族 N≡N ![]() O2- ①、④ CH4 NH3 bd 4NH3+5O2
O2- ①、④ CH4 NH3 bd 4NH3+5O2![]() 4NO+6H2O 氢元素的最高正价和最低负价的绝对值相等(或者氢元素的最高正价与最低负价的代数和为0)
4NO+6H2O 氢元素的最高正价和最低负价的绝对值相等(或者氢元素的最高正价与最低负价的代数和为0)
【解析】E的单质在Z2中燃烧的产物可使品红溶液褪色,该气体为SO2,则E为S元素,Z为O元素,F和Z元素形成的化合物F3Z4具有磁性,则F3Z4为Fe3O4,F为Fe元素,X的单质在Z2中燃烧可生成XZ和XZ2两种气体,X原子序数小于O元素,应为CO和CO2气体,X为C元素,D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则D为Mg元素,Y的原子序数介于碳、氧之间,则Y为N元素,据此解答。
根据以上分析可知X是C,Y是N,Z是O,D是Mg,E是S,F是Fe。则
(1)F为Fe元素,在周期表中的位置是第4周期第Ⅷ族,Y的单质分子为N2,结构式为N≡N,DZ为MgO,属于离子化合物,电子式为![]() 。核外电子排布相同时离子半径随原子序数的增大而减小,则DZ化合物中离子半径较大的是O2-;
。核外电子排布相同时离子半径随原子序数的增大而减小,则DZ化合物中离子半径较大的是O2-;
(2)X为碳元素,碳元素形成的同素异形体有石墨、金刚石、C60等,金刚石属于原子晶体,C60属于分子晶体,答案为:①④;
(3)C、N、O形成的10电子氢化物分别是CH4、NH3、H2O,氨气分子间存在氢键,导致氨气的沸点升高,甲烷中不含氢键,所以沸点较低的是CH4,氨气为碱性气体,NH3结合H+能力较强;
(4)a.单质的硬度和熔、沸点与金属性强弱没有关系,a错误;b.金属性越强,最高价氧化物对应水化物的碱性越强,则比较两元素最高价氧化物对应的水化物溶液的碱性强弱可以比较二者的金属性强弱,b正确;c.两种元素在氯化物中化合价的高低与金属性强弱没有关系,c错误;d.金属性越强,其单质与酸反应越剧烈,则比较单质与同浓度盐酸反应的剧烈程度可以比较金属性强弱,d正确。答案选bd;
(5)Y的氢化物氨气和Z的单质氧气在一定条件下反应生成Z的氢化物(产物之一),该反应属于氨的催化氧化,反应的方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
(6)由于氢元素的最高正价和最低负价的绝对值相等(或者氢元素的最高正价与最低负价的代数和为0),因此建议将氢元素排在元素周期表的ⅣA族。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
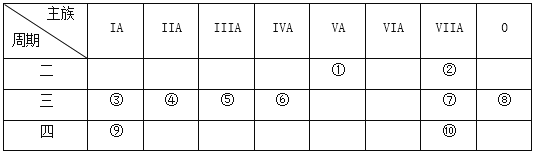
(1)在③~⑦中元素,原子半径最大的是_____________,其离子的结构示意图是__________________。
(2)表中的①~⑩中元素,非金属性最强的是_______,化学性质最稳定的是________,金属性最强的是__________,最高价氧化物的水化物的酸性最强的是(写该水化物的化学式)______________。
(3)⑦的氢化物的水溶液与①的氢化物的水溶液反应的离子方程式为___________________________。
(4)用一个化学反应说明⑦比⑩的单质化学性质活泼,写出反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由三位化学家共同获得,以表彰他们在研究纳米分子机器中的“马达分子”取得的成就,“马达分子”的关键组件是三蝶烯(图1),下列说法正确的是
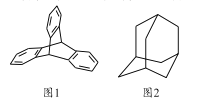
A. 三蝶烯的分子式为C20H16 B. 三蝶烯属于苯的同系物
C. 金刚烷(图2)属于饱和烃 D. 三蝶烯和金刚烷的一氯代物均只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制取乙酸乙酯。
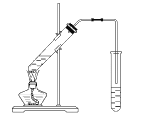
(1)乙酸分子中—COOH原子团的名称是____,写出左侧试管中制取乙酸乙酯的化学反应方程式_______。
(2)装置中通蒸气的导管应置于饱和碳酸钠溶液的液面上而不能插入溶液中,目的是:____________。
(3)浓硫酸的作用是____。
(4)饱和碳酸钠溶液的作用是____。
(5)用30 g乙酸与46 g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是____。
A. 29.5 g B.44 g C.74.8 g D.88 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.盐类物质一定含有金属阳离子
B.蔗糖、NH3、液态HCl均为非电解质
C.能导电的物质不一定属于电解质
D.非金属氧化物一定是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图所示.下列关于分枝酸的叙述正确的是( ) 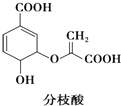
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1 mol分枝酸分子中含2mol﹣OH(羟基)
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为:N2+3H2![]() 2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
A. 达到平衡时,反应速率:v(正)=v(逆)=0
B. 使用催化剂可加快反应速率,提高生产效率
C. 为了提高H2的转化率,应适当增大H2的浓度
D. 若在密闭容器加入1molN2和过量的H2,最后能生成2molNH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三代混合动力车目前一般使用镍氢电池(M表示储氢合金;汽车在刹车或下坡时,电池处于充电状态)。镍氢电池充放电原理的示意图如下:

其总反应式为![]() 。根据所给信息判断,下列说法错误的是
。根据所给信息判断,下列说法错误的是
A. 混合动力汽车上坡或加速时,乙电极的电极反应式为:NiOOH+H2O+eˉ==Ni(OH)2+OHˉ
B. 混合动力汽车上坡或加速时,电解液中OHˉ向甲电极移动
C. 混合动力汽车下坡或刹车时,甲电极周围溶液的pH减小
D. 混合动力汽车下坡或刹车时,电流的方向为:甲电极→发动机→乙电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为![]() ,下列说法不正确的是
,下列说法不正确的是
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸在一定条件下能发生取代反应
D. 1 mol苹果酸与Na2CO3溶液反应最多消耗1 mol Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com