
分析 (1)根据盐的水解规律,含有弱酸根或弱碱根的盐能水解;
(2)向④中加入少量氯化铵固体,c(NH4+)增大,抑制NH3•H2O的电离;
(3)取10mL溶液③,加水稀释到500mL,溶液浓度为原来的$\frac{1}{50}$,为0.01mol/L;
(4)NH3•H2O为弱电解质,不能完全电离,根据电荷守恒分析离子浓度关系;
(5)碳酸钠溶液中碳酸根离子分步水解溶液显碱性;
解答 解:(1)根据盐的水解规律,含有弱酸根或弱碱根的盐能水解,所以①Na2CO3、②NaHCO3能水解;
故答案为:①②;
(2)向④中加入少量氯化铵固体,c(NH4+)增大,抑制NH3•H2O的电离,则c(OH-)减小,所以$\frac{c(N{{H}_{4}}^{+})}{c(O{H}^{-})}$的值增大,故答案为:增大;
(3)取10mL溶液③,加水稀释到500mL,溶液浓度为原来的$\frac{1}{50}$,浓度c(HCl)=0.5mol/L×$\frac{1}{50}$=0.01mol/L,由Kw=c(OH-)•c(H+)可知,c(OH-)=10-12 mol•L-1,则此时溶液中由水电离出的c(H+)=10-12 mol•L-1,
故答案为:10-12 mol•L-1.
(4)NH3•H2O为弱电解质,不能完全电离,如等体积混合,溶液呈酸性,要呈中性氨水应过量,溶液为中性,
故答案为:小于;
(4)Na2CO3溶液中碳酸根离子分步水解溶液显碱性,离子浓度由大到小的顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解、离子浓度大小比较等问题,综合考查学生的化学知识应用能力和分析能力,题目难度中等.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 醋酸与NaOH的反应:H++OH-═H2O | |
| D. | 碳酸镁与稀硫酸:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 四种元素的单质中,Z的熔沸点最低 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Y的气态氢化物的稳定性较Z的弱 | |
| D. | 离子半径:Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42- 沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | (NH4)2 Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 澄清石灰水中加少量NaHCO3:Ca2++2 OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| D. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
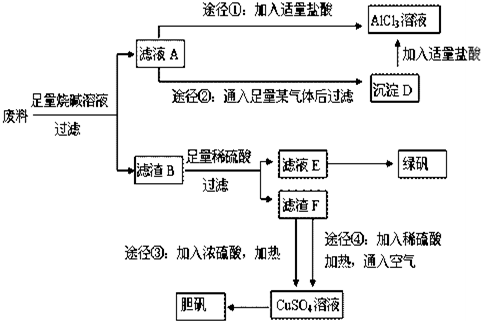
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
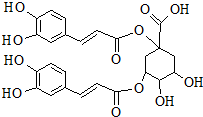 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是( )| A. | 1mol洋蓟素最多可与6molBr2反应 | |
| B. | 1mol洋蓟素最多可与7molNa2CO3反应 | |
| C. | 一定条件下能发生酯化反应和消去反应 | |
| D. | 1mol洋蓟素最多可与9molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
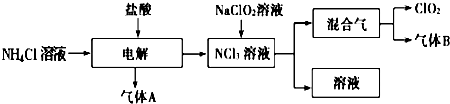
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com