
 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.分析 (1)铝有3个电子层,最外层3个电子;同周期原子半径从左到右依次减小;
(2)该氧化物为氧化铝,氧化铝晶体为离子晶体;氧化铝为两性氧化物,能够与氢氧化钠反应生成偏铝酸钠和水;
(3))氨气属于共价化合物;其分子中含有3个氮氢键,据此写出其电子式;氨气分子中存在氢键,导致其沸点较高;
(4)氮元素的最高价氧化物的水化物为硝酸,其最低价氢化物为氨气,硝酸与氨气反应生成硝酸铵;
(5)根据反应物、生成物书写方程式,该反应中N元素化合价由+3价变为+2价、+5价,则NF3既是氧化剂又是还原剂,依据得失电子守恒写出方程式.
解答 解:(1)铝有3个电子层,最外层3个电子,在周期表中第三周期,第ⅢA族;同周期原子半径从左到右依次减小,铝与钠位于同周期,在钠的右侧,原子半径小于钠原子;
故答案为:第三周期,第ⅢA族;小;
(2)Al单质在空气中不易腐蚀,原因是其表面形成了一种致密的且熔点高的化合物氧化铝,氧化铝属于离子晶体;氧化铝具有两性,能够与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:离子化合物;Al2O3+2OH-=2AlO2-+H2O;
(3)氨气属于共价化合物,其电子式为 ;氨气中N的电负性较强,容易形成氢键,大大增强了分子间作用力,所以其沸点较高,
;氨气中N的电负性较强,容易形成氢键,大大增强了分子间作用力,所以其沸点较高,
故答案为: ; NH3分子间有氢键;
; NH3分子间有氢键;
(4)氮元素的最高价氧化物的水化物为硝酸,其最低价氢化物为氨气,硝酸与氨气反应生成硝酸铵,方程式:HNO3+NH3=NH4NO3;
故答案为:HNO3+NH3=NH4NO3;
(5)反应物是NF3和水,生成物是HF、NO、HNO3,该反应中N元素化合价由+3价变为+2价、+5价,根据转移电子守恒及原子守恒配平方程式为3NF3+5H2O=9HF+2NO+HNO3,故答案为:3NF3+5H2O=9HF+2NO+HNO3.
点评 本题考查了化学方程式书写,原子结构与周期表的关系,电子式的书写,氢键对物质性质的影响,题目综合性强,难度中等,注意氢键只影响物质的物理性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
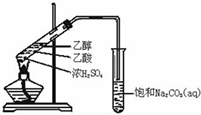 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有果香味.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )
始祖鸟烯形状宛如一只展翅飞翔的鸟,其键线式结构表示如图,其中R1、R2为烷烃基.则下列有关始祖鸟烯的说法中正确的是( )| A. | 始祖鸟烯与乙烯互为同系物 | |
| B. | 若R1=R2=甲基,则其化学式C12H14 | |
| C. | 若R1=R2=甲基,则始祖鸟烯的一氯代物有3种 | |
| D. | 始祖鸟烯既能使酸性高锰酸钾褪色,也能使溴水褪色,则两反应的反应类型是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 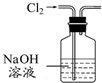 装置除去Cl2中含有的少量HCl | |
| B. |  装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 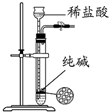 装置制取少量纯净的CO2气体 | |
| D. | 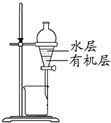 装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都存在羟基 | |
| B. | 甲烷和甲苯都可以与氯气反应 | |
| C. | 高锰酸钾可以氧化甲苯和乙醛 | |
| D. | 乙烯可以发生加成反应,苯不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.1 mol BaCl2的溶液中Cl-数为0.1NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 11.2 L CO2所含有的分子数为0.5NA | |
| D. | 标准状况下,分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com