
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
分析 I.根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
Ⅱ.(1)可逆反应到达平衡时,同一物质的正逆反应速率相等,各组分的浓度、含量不变,由此衍生的一些其它量不变,该物理量应随反应进行发生变化,当该物理量由变化到不变化,说明到达平衡;
(2)恒温恒容下,压强之比对气体物质的量之比,据此计算反应体系的总物质的量;
由表中数据可知,20h与30h时总压强相等,故20h时反应到达平衡,根据压强与总物质的量关系计算此时n总,再结合方程式、利用差量法计算参加反应水的物质的量,进而计算水的转化率;
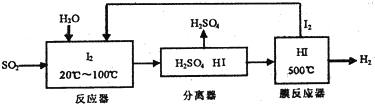
(3)①从流程图可知,在反应器中I2氧化SO2生成硫酸和HI,在膜反应器中HI分解为氢气与I2,碘循环利用,整个过程相当于二氧化硫与水反应生成硫酸与氢气;
②降低生成物的浓度,使平衡向正方向移动;
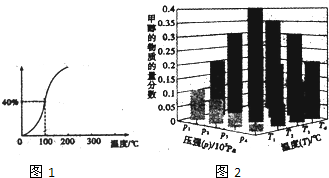
Ⅲ.(1)由图可知,平衡时甲烷的转化率为40%,据此计算参加反应甲烷物质的量,利用三段式计算平衡时各组分的物质的量,进而计算各组分的平衡浓度,代入平衡常数表达式K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$计算;
(2)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,正反应为气体体积减小的吸热反应,增大压强,平衡向正反应方向移动,甲醇的物质的量分数则越大,升高温度,平衡向逆反应方向移动,甲醇的物质的量分数越小.
解答 解:Ⅰ.已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ.mol,
由盖斯定律,③×2-①得到:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),故△H2=(-867kJ•mol-1)×2-(-574kJ•mol-1)=-1160kJ•mol-1,
故答案为:-1160kJ•mol-1;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
Ⅱ.(1)A.随反应进行,混合气体总质量增大,容器容积不变,混合气体密度增大,混合气体密度不变,说明到达平衡,故A正确;
B.消耗1molH2O(g)的同时生成1molH2,均表示正反应速率,二者反应速率始终相等,故B错误;
C.△H与是否到达平衡无关,与反应中各物质的化学计量数有关,故C错误;
D.若V正(CO)=V逆(H2),由速率之比等于其化学计量数之比,则V正(CO)=V逆(CO),故反应到达平衡,故D正确,
故选:AD;
(2)恒温恒容下,压强之比对气体物质的量之比,则P:P0=n总:1mol,故n总=$\frac{P}{{P}_{0}}$mol;
由表中数据可知,20h与30h时总压强相等,故20h时反应到达平衡,平衡时压强为8.2,
则n总=$\frac{8.2}{4.56}$mol,C(s)+H2O(g)?CO(g)+H2(g)物质的量增大
1 1
n(H2O) $\frac{8.2}{4.56}$mol-1mol=$\frac{3.64}{4.56}$mol,
故参加反应n(H2O)=$\frac{3.64}{4.56}$mol,水的转化率为$\frac{\frac{3.64}{4.56}mol}{1mol}$×100%=79.82%,
故答案为:$\frac{P}{{P}_{0}}$;79.82%;
(3)①从流程图可知,在反应器中I2氧化SO2生成硫酸和HI,在膜反应器中HI分解为氢气与I2,碘循环利用,整个过程相当于二氧化硫与水反应生成硫酸与氢气,总反应方程式为:SO2+2H2O=H2SO4+H2,
故答案为:SO2+2H2O=H2SO4+H2;
②分离出氢气,降低生成物的浓度,使平衡向正方向移动,
故答案为:降低生成物的浓度,使平衡向正方向移动;
Ⅲ.(1)由图可知,平衡时甲烷的转化率为40%,参加反应甲烷物质的量为1mol×40%=0.4mol,则:
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始(mol):1 2 0 0
转化(mol):0.4 0.4 0.4 1.2
平衡(mol):0.6 1.6 0.4 1.2
则平衡常数表达式K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{\frac{0.4}{100}×(\frac{1.2}{100})^{3}}{\frac{0.6}{100}×\frac{1.6}{100}}$=7.2×10-5,
故答案为:7.2×10-5;
(2)对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,正反应为气体体积减小的吸热反应,增大压强,平衡向正反应方向移动,甲醇的物质的量分数则越大,升高温度,平衡向逆反应方向移动,甲醇的物质的量分数越小,
由图可知,一定温度下,压强为P1、P2、P3、P4,对应甲醇的质量分数依次增大,正反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,甲醇的质量分数增大,故压强为P1>P2>P3>P4;
一定压强下,温度为T1、T2、T3、T4,对应甲醇的质量分数依次增大,正反应为放热反应,升高温度,平衡向逆反应方向移动,甲醇的质量分数减小,故温度为T1>T2>T3>T4,
故答案为:CD.
点评 本题属于拼合型题目,涉及反应热计算、化学平衡状态判断、化学工艺流程、化学平衡有关计算、化学平衡常数计算、化学平衡图象及影响因素等,需要学生具备扎实的基础,难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 其他条件不变时,若增大压强,则物质Y的转化率减小 | |
| D. | 其他条件不变时,若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
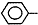 CH=CH2),聚苯乙烯的化学式为
CH=CH2),聚苯乙烯的化学式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3s的平均速率为v(NO2)=0.24mol•L-1•s-1 | |
| B. | 24s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0molNO2、0.5molO3和0.50molN2O5、0.50molO2,反应达到平衡时,压强为起始的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0molN2O5和2.0molO2,达到平衡时,N2O5的转化率大于20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com