
| A.化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因 | ||
| B.常温常压下,用惰性电极电解500mL饱和氯化钠溶液时,若溶液的pH变为13时,则可产生的气体体积为2.24L | ||
| C.NaHSO4溶液与Ba(OH)2溶液反应至中性的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | ||
D.在保持常温下,向醋酸溶液中不断加入CH3COONa固体至溶液的PH=7,则醋酸的电离度减小,
|
| c(H+)?c(CH3COO-) |
| c(CH3COOH) |


科目:高中化学 来源:不详 题型:单选题




| A.a+b=c |
B.1mol H2O由气态变为液态吸收(a-b)kJ热量 |
C.氢气的燃烧热为c/2 kJ |
| D.1molH2 O由液态变为气态吸收l c/2-al kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④ | B.②③ | C.③④⑤ | D.①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 1000 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①中反应物的能量低于产物的能量 |
| B.②中断开H-H键吸收能量,生成H-Cl键放出能量 |
| C.③中断开的化学键属于非极性键 |
| D.①、②、③中原子的稳定性均强于相应分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质燃烧可看成“储存”在物质内部的能量转化为热能、光能等形式释放出来 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.生成物总能量一定低于反应物总能量 |
| D.破坏旧化学键吸收的能量大于形成新化学键释放的能量时,该反应是吸热反应 |
查看答案和解析>>
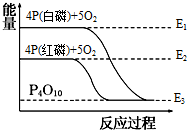
科目:高中化学 来源:不详 题型:单选题
| A.白磷比红磷稳定 |
| B.红磷转变为白磷是吸热反应 |
| C.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+E3-E2 |
| D.白磷燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1 > Q2 | B.Q1 = Q2 | C.2Q1 < Q2 | D.Q1 = 1/2Q2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com