
| A. | 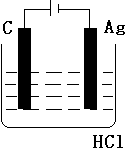 | B. | 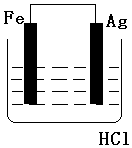 | C. | 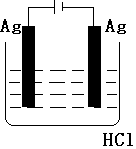 | D. | 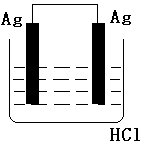 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
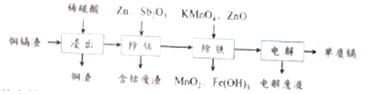
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业电解精炼铜时,粗铜与外电源的正极相连 | |
| B. | 常温下向纯水中加入盐酸,水的离子积减小 | |
| C. | 催化剂既能改变化学反应速率,也能改变焓变 | |
| D. | 其它条件不变时,升髙温度,吸热反应的v(正)增大,v(逆)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | CuCl2 | C. | NaOH | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 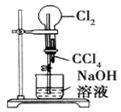 打开止水夹,挤压装置如图的胶头滴管使CCl4全部进入烧瓶 | |
| B. | 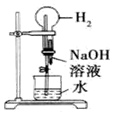 打开止水夹,挤压如图装置的胶头滴管使NaOH溶液全部进入烧瓶 | |
| C. | 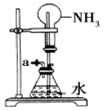 打开止水夹,用鼓气装置从如图装置的a处不断鼓入空气 | |
| D. |  打开止水夹,向如图装置的水槽中慢慢加入足量浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 | |
| B. | 有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 | |
| C. | 有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 | |
| D. | 有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
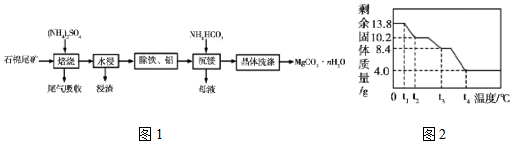
 →
→ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com