
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为( )
A.0.4 mol·L-1 B.0.3 mol·L-1
C.0.2 mol·L-1 D.0.1 mol·L-1
科目:高中化学 来源:2014高考化学二轮专题突破 专题六物质结构和元素周期律练习卷(解析版) 题型:填空题
部分中学化学常见元素原子结构及性质如下表所示:
序号元素结构及性质
①AA单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5
②BB原子最外层电子数是内层电子总数的1/5
③CC是常见化肥的主要元素,单质常温下呈气态
④DD单质被誉为“信息革命的催化剂”,是常用的半导体材料
⑤E通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
⑥FF在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
(1)A元素在周期表中的位置为_______________________________________________。
(2)B与C形成的化合物的化学式为_______________________________________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是__________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________________性,N的结构式为______________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:________________________________________________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:填空题
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若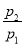 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)  2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
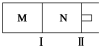
A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y
B.若x∶y=1∶2,则平衡时,M中的转化率:A>B
C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90%
D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正<v逆
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:实验题
奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?
________________________________________________________________________________________________________________________________________________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(3)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵然后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.0 mL,则该样品中N的含量为________。
[已知:滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3]
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
若20 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有2 g Ca(NO3)2,则溶液中NO3-的物质的量浓度为( )
A. 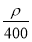 mol·L-1 B.
mol·L-1 B. 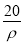 mol·L-1
mol·L-1
C. 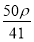 mol·L-1 D.
mol·L-1 D.  mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:选择题
下列各组热化学方程式中,Q1<Q2的是( )
A.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 kJ·mol-1
CH4(g)+3/2O2(g)=CO(g)+2H2O(g) ΔH=-Q2 kJ·mol-1
B.S(g)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
C.H2(g)+Br2(g)=2HBr(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
D.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-Q1 kJ·mol-1
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-Q2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
《美国化学会志》报道:中国科学家以二氧化碳为碳源、金属钠为还原剂,在470 ℃,80 MPa条件下合成出金刚石,具有深远意义。下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化
B.此反应中金刚石是氧化产物
C.金刚石是碳单质的一种同素异形体
D.此反应中钠元素发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41.2 kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH=-41.2 kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1)已知:850 ℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
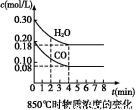
下列说法正确的是 (填序号)。
A.达到平衡时,氢气的物质的量是0.12 mol
B.达到平衡时,反应体系最终会放出49.44 kJ热量
C.第4 min时,混合气体的平均相对分子质量不再变化
D.第6 min时,若升高温度,反应平衡常数会减小
E.第8 min时,若充入氦气,会导致v(CO)正<v(H2O)逆
(2)850 ℃时,若在容积为2 L的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2。若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com