
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
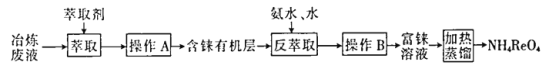
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
【答案】 +7 分液 ①③④ 萃取有机层中ReO4- 2NH4ReO4![]() 2NH3↑+H2O↑+Re2O7 H2除作还原剂外,还作保护气、用于排尽装置内空气等合理答案 3.0×106
2NH3↑+H2O↑+Re2O7 H2除作还原剂外,还作保护气、用于排尽装置内空气等合理答案 3.0×106
【解析】(1)根据正负化合价的代数和为0计算;
(2)根据流程图,用萃取剂萃取后得到含铼有机层和水层,据此分析解答;根据萃取剂选择的条件分析判断;
(3)根据流程图,经过用氨水、水作萃取剂进行反萃取后可以得到富铼溶液分析解答;
(4)依题意,高铼酸铵分解是非氧化还原反应,据此书写方程式;联系氢气还原氧化铜实验解答;
(5)根据4ReS2+15O2![]() 2Re2O7+8SO2,结合氧化还原反应的规律计算。
2Re2O7+8SO2,结合氧化还原反应的规律计算。
(1)NH4ReO4(高铼酸铵)中N为-3价,H为+1价,O为-2价,根据正负化合价的代数和为0,铼元素化合价为+7价,故答案为:+7;
(2)根据流程图,用萃取剂萃取后得到含铼有机层和水层,分离的方法为分液,“萃取”中萃取剂应具有的性质:萃取剂难溶于水;ReO4-在萃取剂中的溶解度大于在水中的溶解度;萃取剂不和ReO4-发生反应,故答案为:分液;①③④;
(3)反萃取指用氨水、水作萃取剂,可以将有机层中ReO4-夺出来,分离出水层和有机层,ReO4-进入水溶液,故答案为:萃取有机层中ReO4-;
(4)①依题意,高铼酸铵分解是非氧化还原反应,生成七氧化二铼外,还有水、氨气,反应的化学方程式为2NH4ReO4![]() 2NH3↑+H2O↑+Re2O7,故答案为:2NH4ReO4
2NH3↑+H2O↑+Re2O7,故答案为:2NH4ReO4![]() 2NH3↑+H2O↑+Re2O7;
2NH3↑+H2O↑+Re2O7;
②工业上,利用氢气还原Re2O7制备铼,氢气起三个作用:作还原剂、作保护气、用氢气排空气,因此根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,故答案为:H2除作还原剂外,还作保护气、用于排尽装置内空气;
(5)4ReS2+15O2![]() 2Re2O7+8SO2,生成1 mol Re2O7时,转移30 mol电子。n(Re2O7)=
2Re2O7+8SO2,生成1 mol Re2O7时,转移30 mol电子。n(Re2O7)=![]() =1.0×105 mol,转移电子的物质的量:n(e-)=3.0×106 mol,故答案为:3.0×106。
=1.0×105 mol,转移电子的物质的量:n(e-)=3.0×106 mol,故答案为:3.0×106。


科目:高中化学 来源: 题型:
【题目】化学来源于生活又服务于生活,化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。流程如下:
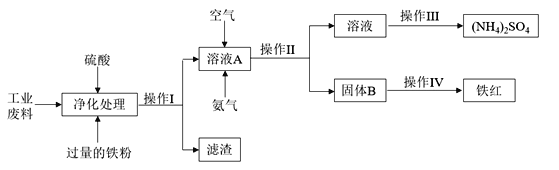
请回答下列问题:
(1)操作I的名称________________,滤渣的成分为__________________。
(2)简述下列实验操作:
①检验溶液A中金属阳离子的方法为____________________________________________________;
②检验固体B是否洗涤干净的方法是____________________________________________________。
(3)请写出溶液A中反应的离子方程式_______________________________________________________
(4) 测定废料中硫酸铜的质量分数:称取a g废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数为_______________(写出表达式。)
(5) 某同学提出另一种制备铁红的方法:往工业废水中加入足量的硫酸和双氧水,通过下列操作也可以得到铁红,请配平下列离子方程式_____ Fe2++ _____ H2O2 + _____ H+= _____ Fe3+ + ____ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明的酸性溶液中,能共存的离子组是
A. NH4+、NO3-、Al3+、Cl-
B. Na+、OH-、K+、NO3-
C. MnO4-、K+、SO42-、Na+
D. K+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 A、B、C、D、E、F 是六种短周期主族元素,原子序数依次增大。A、C、F 的单质在常温下呈气态,B 的原子最外层电子数是其电子层数的 2 倍,A 与 D 同主族,C 的气态氢化物能与其最高价氧化物的水化物反应,E 是地壳中含量最高的金属元素。清回答下列问题:
(1)F 的元素符号为______,B、C、D、E 四种元素原子半径由大到小的顺序是(写元素符号)_____。
(2)B 在元素周期表中的位置为_____,B 与硫元素形成的二元化合物的电子式为_____。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式)_____。
(4)由 A,C,F 组成的一种常见的盐中结构中包含_____(选填“离子键”“极性键”和“非极性键”)
(5)单质 B 和元素 C 的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市政府规划将一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的红棕色烟雾的困扰。你估计这一空气污染物可能含有( )
A. FeO粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)如图装置A烧瓶内试剂可选用______(填序号);①浓硫酸 ②碱石灰 ③五氧化二磷 ④烧碱固体;实验室制取氨气常用另外一种固体和固体加热的方法,写出该方法的化学方程式______________________。
(2)若探究氨气的溶解性,上图需在K2的导管末端连接下图装置中的_________装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________________。
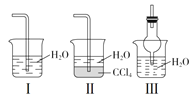
(3)若探究氨气的还原性,需打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置,D中氨气与氯气反应产生白烟,该反应的化学方程式为__________________。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为__________,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为_____g(小数点后保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com