
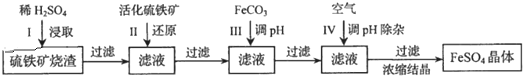
分析 硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体,据此解答;
(1)H2SO4与Fe2O3反应生成硫酸铁与水;
(2)用KSCN 溶液检验第Ⅱ步中Fe3+是否完全还原;
(3)氧气可以讲亚铁离子氧化为铁离子,铁离子水解使溶液pH降低;
(4)发生反应:4FeCO3+O2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-.
解答 解:硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体,
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,取第Ⅱ步反应中溶液少许与试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,故答案为:C;
(3)氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+,使溶液pH降低,故答案为:氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+;
(4)发生反应:4FeCO3+O2$\frac{\underline{\;加热\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-.
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、电极反应式、化学计算等,需要学生熟练掌握元素化合物知识,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5mol HCl | B. | 2.5mol H2O | ||
| C. | 108.5g 33.6%的盐酸 | D. | 145g 50.3%的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其生腐蚀 | |
| B. | 反应SO2(g)+2H2S(g)=3S(S)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和溶液中水的电离程度均增大 | |
| D. | 常温下,将等体积、等物质的量浓度的NaHCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,存在KW/c(H+)>1.0×10-7 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4=FeSO4+H2↑ | D. | MgCO3+2HCl═2HCl2+CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com