
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.4Q | B.5Q | C.8Q | D.16Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
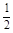 O2(g) =H2O(l) △H2=–285.8 kJ/mol
O2(g) =H2O(l) △H2=–285.8 kJ/mol| A.△H=244.1kJ/mol | B.△H=-488.3kJ/mol |
| C.△H=-996.6kJ/mol | D.△H=996.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
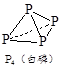
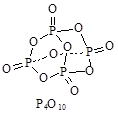
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+ (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 |
| B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为: N2(g)+3H2(g)  2NH3(g)△H="—38.6" kJ·mol—1 2NH3(g)△H="—38.6" kJ·mol—1 |
| C.标准状况:H2(g)+F2(g) ==="2HF(g)" △H=-270kJ/mol, |
| D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g)△H=-1025 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com