
【题目】现有浓度均为0.1molL﹣1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) .
(2)已知T℃,KW=1×10﹣13 , 则T℃25℃(填“>”、“<”或“=”).在T℃时将pH=11的NaOH溶液aL与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a:b= .
(3)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:①若x+y=14,则 ![]() =(填数据);
=(填数据);
②若x+y=13,则 ![]() =(填数据);
=(填数据);
③该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为
(填表达式).
【答案】
(1)④②③①
(2)>;2:9
(3)1;0.1;x+y=14+lg ![]()
【解析】解:(1)氯化铵促进水的电离,硫酸、醋酸、氢氧化钠抑制水的电离,H2SO4中氢离子浓度是0.2mol/L、醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,所以答案是:④②③①;(2)T℃时KW=1×10﹣13>10﹣14 , 水的电离是吸热,温度升高促进电离,水的离子积增大,故T℃>25℃,pH=11的NaOH溶液浓度为 ![]() mol/L=10﹣3 mol/L,pH=1的硫酸中氢离子浓度为0.1mol/L,若所得混合溶液的pH=10,溶液呈碱性,氢氧化钠有剩余,则
mol/L=10﹣3 mol/L,pH=1的硫酸中氢离子浓度为0.1mol/L,若所得混合溶液的pH=10,溶液呈碱性,氢氧化钠有剩余,则 ![]() =
= ![]() ,整理可得a:b=2:9,所以答案是:>;2:9;(3)盐酸与氢氧化钠恰好中和,则n(HCl)=n(NaOH),可得a×10﹣x=b×
,整理可得a:b=2:9,所以答案是:>;2:9;(3)盐酸与氢氧化钠恰好中和,则n(HCl)=n(NaOH),可得a×10﹣x=b× ![]() ,整理可得:
,整理可得: ![]() =10x+y﹣14 . ①若x+y=14,则
=10x+y﹣14 . ①若x+y=14,则 ![]() =10x+y﹣14=1014﹣14=1,所以答案是:1;②若x+y=13,则
=10x+y﹣14=1014﹣14=1,所以答案是:1;②若x+y=13,则 ![]() =10x+y﹣14=1013﹣14=0.1,所以答案是:0.1;③该盐酸与该氢氧化钠溶液完全中和,满足
=10x+y﹣14=1013﹣14=0.1,所以答案是:0.1;③该盐酸与该氢氧化钠溶液完全中和,满足 ![]() =10x+y﹣14 , 则x+y=14+lg
=10x+y﹣14 , 则x+y=14+lg ![]() ,所以答案是:x+y=14+lg
,所以答案是:x+y=14+lg ![]() .
.
【考点精析】关于本题考查的弱电解质在水溶液中的电离平衡,需要了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能得出正确答案.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 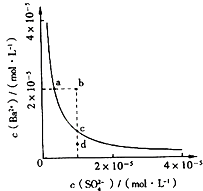
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物。下列物质不属于氢化物的是
A. H2SO4 B. H2O C. NaH D. NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙醇分子中有一个羟基的事实是( )
A.乙醇完全燃烧生成CO2和H2O
B.0.1mol乙醇与足量钠反应生成0.05mol氢气
C.乙醇能溶于水
D.乙醇能脱水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应
4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)═CH3OCH3(g)+3H2O(g)△H<0①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变 b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出).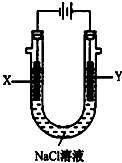
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。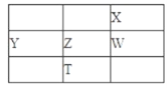
下列说法正确的是
A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化时需克服离子键
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:④_______;________。
(2)画出原子的结构示意图:⑤_________;________。
(3)在①~元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________ (均填元素符号)。
(4)元素⑦与元素⑧相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________(填序号)。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为_____。且该氧化物可溶解在强碱NaOH中其离子方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com