
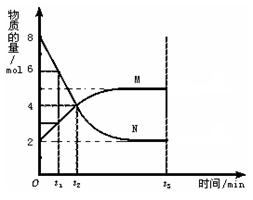
| A.t2时刻该反应达到平衡 |
| B.t3时刻该反应达到平衡 |
| C.反应开始时,生成物的浓度为0 |
| D.该反应的限度是可以改变的 |
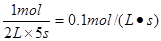 。
。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源:不详 题型:单选题
| A.氢气和氯气点燃生成氯化氢,氯化氢受热分解为氢气和氯气 |
| B.氮气和氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气 |
| C.单质溴可以置换出碘,氯气又可以置换出溴 |
| D.氯气和水反应生成盐酸和次氯酸,次氯酸光照条件下可分解为盐酸和氧气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
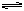 N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
| A.负极的电极反应式为:CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
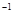 的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:
的盐酸与未知浓度的NaOH溶液以1:2的体积比混合,所得溶液的PH为2。用上述 NaOH溶液与某一元弱酸HA 20.0mL反应,恰好中和时消耗NaOH溶液10.0mL,所得溶液PH为10。求:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2O4,△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ( )
N2O4,△H<0。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ( )| A.①和③ | B.②和④ | C.④和⑤ | D.③和⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2HI(g)△H=-9.48 kJ/mol
2HI(g)△H=-9.48 kJ/mol  2HI(g)△H=+26.48 kJ/mol
2HI(g)△H=+26.48 kJ/mol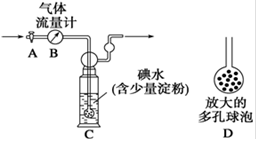
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的75%,则化学方程式中的n值是( )
4X(气)+nY(气)。反应完全后,容器温度不变,混和气体的压强是原来的75%,则化学方程式中的n值是( ) | A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.收集氯气用排饱和食盐水的方法 |
| B.加催化剂,使N2和H2在一定的条件下转化为NH3 |
| C.可用浓氨水和氢氧化钠固体快速制取氨气 |
| D.加压条件下有利于SO2和O2反应生成SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2,在高温、高压和催化剂存在条件下发生反应。下列有关说法正确的是( )| A.最终可以生成2mol NH3 |
| B.达到化学平衡状态时,正反应和逆反应的速率都为0 |
| C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1∶3∶2 |
| D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com