
| A�� | 25�棬$\frac{{K}_{W}}{c��{H}^{+}��}$=0.1mol/L����Һ�У�ClO-��Cl-��K+��HSO3- | |
| B�� | ��ɫǿ������Һ�У�Na+��Cl-��SO42-��[Cu��NH3��4]2+ | |
| C�� | ˮ���������c��H+��=10-13 mol•L-1����Һ�У�Na+��Cl-��NO3-��SO42- | |
| D�� | ����Al�ܷų�H2����Һ�У�NH4+��SO42-��Br-��NO3- |
���� A��25�棬$\frac{{K}_{W}}{c��{H}^{+}��}$=0.1mol/L����ҺΪ������Һ����Һ�д��ڴ������������ӣ�������������ܹ�����������������ӣ���������������ܹ������������ӷ����кͷ�Ӧ��
B��ǿ������Һ�д��ڴ��������ӣ�[Cu��NH3��4]2+Ϊ��ɫ���ӣ����ܹ��������ӷ�Ӧ��
C��ˮ���������c��H+��=10-13 mol•L-1����ҺΪ���Ի������Һ����������֮�䲻��Ӧ�������������Ӻ����������ӷ�Ӧ��
D������Al�ܷų�H2����Һ�д��ڵ��������ӻ����������ӣ�笠����������������ӷ�Ӧ�����������������������������Ӧ��������������
��� �⣺A��25�棬$\frac{{K}_{W}}{c��{H}^{+}��}$=0.1mol/L����Һ�д��ڴ������������ӣ�ClO-��HSO3-֮�䷢��������ԭ��Ӧ��HSO3-�����������ӷ����кͷ�Ӧ������Һ�в��ܴ������棬��A����
B��[Cu��NH3��4]2+Ϊ��ɫ���ӣ���[Cu��NH3��4]2+�ܹ���ǿ������Һ�е������ӷ�Ӧ������Һ�в��ܴ������棬��B����
C��ˮ���������c��H+��=10-13 mol•L-1����Һ�д��ڴ������������ӻ������ӣ�Na+��Cl-��NO3-��SO42-֮�䲻��Ӧ�������������ӡ����������ӷ�Ӧ������Һ���ܹ��������棬��C��ȷ��
D������Al�ܷų�H2����ҺΪ���Ի�ǿ������Һ��NH4+�����������ӷ�Ӧ��NO3-�����������¾���ǿ�����ԣ�������Ӧ����������������D����
��ѡC��
���� ���⿼�����ӹ�����жϣ�Ϊ�߿��ĸ�Ƶ�⣬��Ŀ�Ѷ��еȣ�ע���������ӷ�Ӧ������������ȷ���Ӳ��ܴ��������һ���������Ӧ��ע����Ŀ���������������磺��Һ������ԣ��ݴ����ж���Һ���Ƿ��д����� H+��OH-����Һ����ɫ������ɫʱ���ų� Cu2+��Fe2+��Fe3+��MnO4-����ɫ���ӵĴ��ڣ���Һ�ľ��巴Ӧ�������硰������ԭ��Ӧ�������������۲������������ǡ����ܡ����棬���ǡ�һ��������ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ǿ������Һ��Mg2+��NH4+��Cl-��NO3- | |
| B�� | ʹ���ȱ�����Һ��Na+��Fe3+��Cl-��S2O32- | |
| C�� | ��ɫ��Һ�У�K+��Al3+��HCO3-��Cr2O72- | |
| D�� | �����£�$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��10-12����Һ��K+��Na+��AlO2-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
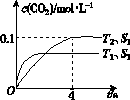

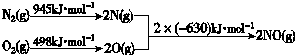
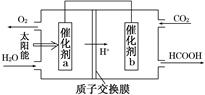
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���� | �Լ� | ��Ҫ���� | |
| A | Fe2O3 | SiO2 | NaOH | ���� |
| B | CO2 | CO | O2 | ��ȼ |
| C | FeCl2��Һ | FeCl3 | Cu | ��Һ |
| D | CH3CH2OH | H2O | Na | ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
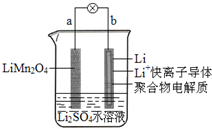 2013��3���ҹ���ѧ�ұ�������ͼ��ʾ��ˮ��Һ����ӵ����ϵ����������������ǣ�������
2013��3���ҹ���ѧ�ұ�������ͼ��ʾ��ˮ��Һ����ӵ����ϵ����������������ǣ�������| A�� | aΪ��ص����� | |
| B�� | ��طŵ練ӦΪLiMn2O4=Li1-xMn2O4+xLi | |
| C�� | �ŵ�ʱ��a��﮵Ļ��ϼ۲������仯 | |
| D�� | �ŵ�ʱ����Һ�е�Li+��b��aǨ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| NaCl | KCl | MgO | AlCl3 | SiC | ����B | CCl4 | CBr | |
| �۵�/�� | 801 | 772 | 2800 | 190 | 2600 | 2300 | -22.9 | 90 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com