
 ŅŃÖŖ£ŗSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©”÷H=-a kJ•mol-1
ŅŃÖŖ£ŗSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©”÷H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| ČŪµć/”ę | -54.1 | -101 | -72.4 |
| ·Šµć/”ę | 69.1 | -34.6 | -10 |
| ŠŌÖŹ | ÓöĖ®·¢Éś¾ēĮŅĖ®½ā | / | / |
·ÖĪö £Ø1£©ÓÉ¢ŁSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©”÷H=-a kJ•mol-1
¢ŚSO2Cl2£Øl£©+SCl2£Øg£©?2SOCl2£Øg£©”÷H=©b kJ•mol-1
½įŗĻøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ł-¢ŚµĆµ½SO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©£¬KĪŖÉś³ÉĪļÅضČĆŻÖ®»żÓė·“Ó¦ĪļÅضČĆŻÖ®»żµÄ±Č£»
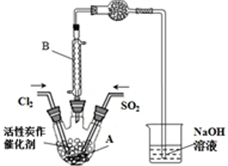
£Ø2£©¢ŁBĪŖĄäÄż¹Ü£¬Ķ¼ÖŠĪŽ¼ÓČČ×°ÖĆ£¬æÉÖŖøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬øÉŌļ¹ÜæÉ·ĄÖ¹Ė®ÕōĘų½ųČėAÖŠ£»
¢ŚÅØŃĪĖįÓėøßĆĢĖį¼ŲĪŖŌĮĻÖĘČ”Cl2£¬Éś³ÉĀČ»Æ¼Ų”¢ĀČ»ÆĆĢ”¢ĀČĘųŗĶĖ®£»
¢ŪĪŖ·ÅČČ·“Ó¦£¬½µĪĀĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£»½įŗĻ±ķøńŹż¾ŻæÉÖŖ£¬»ģŗĻĪļ·Šµć²»Ķ¬£»
¢ÜSO2Cl2ÓėNaOHČÜŅŗ·“Ó¦£¬ĪŖ·ĒŃõ»Æ»¹Ō·“Ó¦£¬Éś³ÉĮņĖįÄĘ”¢ĀČ»ÆÄĘŗĶĖ®£»
¢Żn£ØCl2£©=$\frac{0.896L}{22.4L/mol}$=0.04mol£¬ÓÉSO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©æÉÖŖ£¬ĄķĀŪÉś³ÉSO2Cl2ĪŖ0.04mol”Į135g/mol=5.4g£¬ŅŌ“Ė¼ĘĖć²śĀŹ£®
½ā“š ½ā£ŗ£Ø1£©ÓÉ¢ŁSO2£Øg£©+Cl2£Øg£©+SCl2£Øg£©?2SOCl2£Øg£©”÷H=-a kJ•mol-1
¢ŚSO2Cl2£Øl£©+SCl2£Øg£©?2SOCl2£Øg£©”÷H=©b kJ•mol-1
½įŗĻøĒĖ¹¶ØĀÉæÉÖŖ£¬¢Ł-¢ŚµĆµ½SO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©£¬
Ōņ”÷H=£Ø-a-b£©kJ•mol-1£¬øĆ·“Ó¦Ę½ŗā³£Źż±ķ“ļŹ½ĪŖK=$\frac{c£ØS{O}_{2}C{l}_{2}£©}{c£ØS{O}_{2}£©c£ØC{l}_{2}£©}$£¬
¹Ź“š°øĪŖ£ŗ£Ø-a-b£©kJ•mol-1£»$\frac{c£ØS{O}_{2}C{l}_{2}£©}{c£ØS{O}_{2}£©c£ØC{l}_{2}£©}$£»
£Ø2£©¢ŁBŅĒĘ÷ŌŚ±¾ŹµŃéÖŠµÄ×÷ÓĆŹĒĄäÄżSO2Cl2£Ø»ņŹ¹»Ó·¢µÄ²śĪļSO2Cl2ĄäÄż£©£¬Ķ¼ÖŠĪŽ¼ÓČČ×°ÖĆ£¬·“Ó¦æɳ֊ų·¢Éś£¬æÉÖŖøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬øÉŌļ¹ÜµÄ×÷ÓĆŹĒ·ĄÖ¹Ė®ÕōĘų½ųČėAÓėSO2Cl2·¢ÉśĖ®½ā·“Ó¦£¬ĪüŹÕSO2ŗĶCl2ĘųĢ壬·ĄÖ¹ĪŪČ¾æÕĘų£¬
¹Ź“š°øĪŖ£ŗĄäÄżSO2Cl2£Ø»ņŹ¹»Ó·¢µÄ²śĪļSO2Cl2ĄäÄż£©£»·Å£»·ĄÖ¹Ė®ÕōĘų½ųČėAÓėSO2Cl2·¢ÉśĖ®½ā·“Ó¦£¬ĪüŹÕSO2ŗĶCl2ĘųĢ壬·ĄÖ¹ĪŪČ¾æÕĘų£»
¢ŚÓĆÅØŃĪĖįÓėøßĆĢĖį¼ŲĪŖŌĮĻÖĘČ”Cl2£¬Ōņ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2MnO4-+16H++10Cl-=2Mn2++5Cl2”ü+8H2O£¬
¹Ź“š°øĪŖ£ŗ2MnO4-+16H++10Cl-=2Mn2++5Cl2”ü+8H2O£»
¢ŪĪŖ·ÅČČ·“Ó¦£¬½µĪĀĪĀ¶ČĘ½ŗāÕżĻņŅĘ¶Æ£¬ŌņŃ”Ōń±łĖ®Ō”£»½įŗĻ±ķøńŹż¾ŻæÉÖŖ£¬»ģŗĻĪļ·Šµć²»Ķ¬£¬ŌņŃ”ŌńÕōĮó·ÖĄė£¬¹Ź“š°øĪŖ£ŗB£»G£»
¢ÜSO2Cl2ÓėNaOHČÜŅŗ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖSO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O£¬¹Ź“š°øĪŖ£ŗSO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O£»
¢Żn£ØCl2£©=$\frac{0.896L}{22.4L/mol}$=0.04mol£¬ÓÉSO2£Øg£©+Cl2£Øg£©?SO2Cl2£Øg£©æÉÖŖ£¬ĄķĀŪÉś³ÉSO2Cl2ĪŖ0.04mol”Į135g/mol=5.4g£¬×īŗóµĆµ½“æ¾»µÄ»Ēõ£Ńõ3.3g£¬Ōņ»Ēõ£ĀČµÄ²śĀŹĪŖ$\frac{3.3g}{5.4g}$”Į100%=61.1%£¬¹Ź“š°øĪŖ£ŗ61.1%£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄÖʱøŹµŃé¼°»ÆŃ§Ę½ŗā¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕøĒĖ¹¶ØĀÉÓ¦ÓĆ”¢ÖʱøŌĄķ”¢Źż¾ŻÓ¦ÓĆ”¢»ģŗĻĪļ·ÖĄėĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāŃõ»Æ»¹Ō·“Ó¦µÄÓ¦ÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
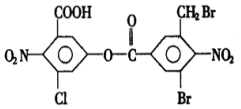
| A£® | 5mol£¬10mol | B£® | 6mol£¬2mol | C£® | 8mol£¬4mol | D£® | 8mol£¬2mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na+”¢Mg2+”¢Cl-”¢SO42- | B£® | Cu2+”¢Cl-”¢NO3-”¢OH- | ||
| C£® | Ca2+”¢Na+”¢CO32-”¢NO3- | D£® | K+”¢Fe3+”¢NO3-”¢SCN- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŌŖ ĖŲ | M | F | |
| µēĄėÄÜ £ØkJ•mol-1£© | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| ČŪµć/K | ·Šµć/K | ±ź×¼×“æöŹ±ŌŚĖ®ÖŠµÄČܽā¶Č | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | ŅŌČĪŅā±Č»„ČÜ |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ·ÅµēŹ±£¬Õż¼«·¢ÉśµÄ·“Ó¦ŹĒPb+SO42-ØTPbSO4+2e- | |
| B£® | ŌŚ·ÅµēŹ±£¬øƵē³ŲµÄøŗ¼«²ÄĮĻŹĒĒ¦°å | |
| C£® | ŌŚ³äµēŹ±£¬µē³ŲÖŠĮņĖįµÄÅØ¶Č²»¶Ļ±äŠ” | |
| D£® | ŌŚ³äµēŹ±£¬Ńō¼«·¢ÉśµÄ·“Ó¦ŹĒPbSO4+2e-ØTPb+SO42- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 mol CO2µÄÖŹĮæŹĒ44g | |
| B£® | 17 g NH3µÄĢå»żŹĒ22.4 L | |
| C£® | 100 mL 1 mol/L NaOHČÜŅŗÖŠŗ¬ÓŠ1 mol OH- | |
| D£® | ±ź×¼×“æöĻĀ£¬11.2 L O2ÖŠŗ¬ÓŠ6.02”Į1023øöŃõ·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com