
| A. | 可以从海水中提取出铀和重水等核能开发中的重要原料 | |
| B. | 利用潮汐发电是将化学能转化为电能 | |
| C. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| D. | 海水中含有钾元素,只需通过物理变化就可以得到钾单质 |
分析 A、铀是裂变核弹,重水(D2O)中的D可以聚变成He放能,威力更大,是聚变核弹;
B、潮汐发电是潮汐能转化为电能;
C、海水蒸发制海盐的过程是蒸发溶剂析出晶体的过程;
D、海水中的钾元素以钾离子的形式存在.
解答 解:A、铀是裂变核弹,重水(D2O)中的D可以聚变成He放能,威力更大,是聚变核弹,从海水中可以提取铀和重水等核原料,用于国防科技,故A正确;
B.因朝汐发电是朝汐能转化为电能,不是化学能转化为电能,故B错误;
C、海水蒸发制海盐的过程是利用氯化钠溶解度随温度饱和不大,蒸发溶剂得到氯化钠晶体,属于物理变化过程,故B错误;
D、在海水中钾是以K+的形式存在,要转化为钾单质,钾元素必然降价,要发生还原反应,所以只经过物理变化不能从海水中得到钾单质,故D错误;
故选A.
点评 本题主要考查基本知识和基本反应原理,需要正确记忆并深化理解,注意基础知识的积累,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25°C时,Mg(OH)2固体在20mL0.01 mol•L-1氨水中的Ksp比在20mL0.01mol•L-1NH4Cl溶液中的Ksp小 | |
| D. | 25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径按X、Y、Z、R、W的顺序一次增大 | |
| B. | WY2能与强碱溶液反应,但不能与任何酸反应 | |
| C. | Z与Y形成的化合物是碱性氧化物 | |
| D. | W的最高价氧化物对应的水化物难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
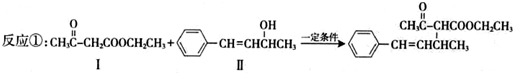
 .
.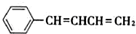 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Mg2+、SCN-、Cl- | B. | Al3+、Mg2+、CO32-、Cl- | ||
| C. | K+、Ag+、Ca2+、NO3- | D. | Na+、H+、CH3COO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:
某同学按如图所示的装置(a、b是电极,c为电解质溶液)分别进行了下表列出的四组实验:| 组别 | a | b | c中的溶质 |
| 甲 | C | C | KOH |
| 乙 | Cu | Cu | NaCl |
| 丙 | Cu | Cu | CuSO4 |
| 丁 | C | C | NaCl |
| A. | 甲实验中溶液的pH要变小,两极均有气体放出 | |
| B. | 乙实验中发生反应的总反应式为:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$ Cu(OH)2↓+H2↑ | |
| C. | 丙实验中c溶液的浓度不变,a极质量增大 | |
| D. | 丁实验中a极电极反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴入石蕊试液 | |
| B. | 加入金属钠 | |
| C. | 加入银氨溶液(微热) | |
| D. | 加入氢氧化钠溶液后加热蒸馏,在馏出物中加入银氨溶液(微热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com