
S-诱抗素制剂能保持鲜花盛开,S-诱抗素的分子结构如图,下列关于该物质说法正确的是

A.S-诱抗素制剂能发生酯化反应的官能团有2种
B.含有苯环、羟基、羰基、羧基、碳碳双键
C.1 mol S-诱抗素制剂与足量金属Na反应生成0.5 mol H2
D.该化合物不能发生聚合反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年安徽省黄山市高三毕业班第二次质量检测理综化学试卷(解析版) 题型:选择题
已知NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0. 020 mol/L的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图;据图分析,下列判断不正确的是

A.40℃之前,溶液变蓝的时间随温度的升高而缩短
B.图中a点对应的NaHSO3反应速率为5.0×l0-5mol/(L·s)
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(15分)下表为元素周期表中的前四周期元素,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。

(1)元素⑦可形成18电子的氢化物X其电子式为 ,⑥与⑨形成的5原子分子的结构式为 。
(2)①②③④⑤五种元素最高价氧化物对应水化物中,碱性最强的是 (填化学式),该物质内部含有的化学键类型是 。
(3)④形成的简单离子的结构示意图 。
(4)第五周期元素中,与⑨元素同主族的元素原子序数为 ,用一个离子方程式比较该元素与⑨元素的非金属性强弱 。
(5)⑦的氢化物比⑧的氢化物的熔沸点高的原因是___ __
(6)⑤的单质与①的最高价氧化物对应的水化物反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列排列顺序不正确的是
A.热稳定性:HF>HCl>HBr B.原子半径:Na>S>O
C.酸性:H3PO4>H2SO4>HClO4 D.元素金属性:Na>Mg>Al
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.HCl的电子式H:Cl
B.HClO的结构式H-Cl-O
C.Cl-的结构示意图
D.质量数为37的氯原子 17 37Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉市高三毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
分子式为C9H12O属于芳香醇且苯环上有三个取代基的同分异构体共有
A.4种 B.5种 C.6种 D.8种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省八市高三教学质量监测考试理科综合化学试卷(解析版) 题型:实验题
(14分)磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69 1℃,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。

(1)仪器E的者称是_______,由B的使用可知SO2与氧气之间的反应居于______(填“放”或“吸”)热反应,仪器C的作用是________________________.
(2)仪器组装完毕后,检验甲装置气密性的方法是____________表明装置气密性良好。
(3)试剂X、Y的组合最好是_________。
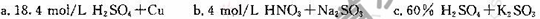
(4)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(5)反应结束后,将丙中混合物分离开的实验操作是_________。若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2 足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列各组离子在一定条件下能够大量共存的是
A.无色溶液:Cu2+、K+、MnO4-、SO42-
B.能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3-
C.常温下c(OH-)=1×10-13mol·L-1的溶液:NH4+、Al3+、SO42-、Cl-
D.含1.2 mol·L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河北区高三总复习质量检测一化学试卷(解析版) 题型:选择题
碱性电池有容量大,放电电流大的特点,被广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn + 2MnO2 + H2O=Zn(OH)2+Mn2O3。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2 + H2O+2e-==Mn2O3 + 2OH-
C.外电路中每通过0.2mol电子,锌的质量理论上减少13g
D.电池工作时,电子由负极通过外电路流向正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com