
一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)  pC(g),达平衡后,温度一定时,将气体体积缩小原来的1/2,当达到新的平衡时,C的浓度为原来的1.9倍,若压缩过程中保持温度不变,则反应方程式中两边系数关系是
pC(g),达平衡后,温度一定时,将气体体积缩小原来的1/2,当达到新的平衡时,C的浓度为原来的1.9倍,若压缩过程中保持温度不变,则反应方程式中两边系数关系是
A.m+n=p B.m+n>p C.m+n<p D.无法确定
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
某研究性学习小组对过量炭粉与氧化铁反应中气体产物的成分进行了研究。
【提出假设】 该反应中的气体产物可能是CO或者是CO2和CO的混合物。
【查阅资料】 氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
【设计方案】 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉充分反应,测定参加反应的碳元素与氧元素的质量比。
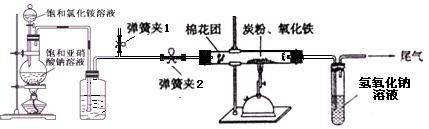 |
试回答下列问题:
(1) 按上图连接装置,如何检查该装置的气密
性 。
(2) 广口瓶内盛放的试剂为 ,其作用
为 。
(3) 实验开始时,应先打开弹簧夹2一段时间后关闭,同时打开弹簧夹1;再点燃酒精喷灯,理由是
; 。
(4) 称取3.20 g氧化铁、2.00 g炭粉混合均匀,放入质量为48.48 g的硬质玻璃管中;待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24 g。经进一步测定得知参加反应的氧元素质量为0.96 g。从而确认该反应的气体产物是CO2和CO的混合物,理由是 。根据数据处理结果判断,反应产生的气体中n(CO2): n(CO)= ,
(5) 有同学根据实验得出的结论,认为应对实验装置进一步完善,你认为应作如何改进?
。
查看答案和解析>>
科目:高中化学 来源:2010年广东省东莞市五校联考高二上学期期中考试化学卷 题型:选择题
将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+2O2 (g) 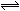 2SO3(g)
(正反应放热)。下列能判断该反应达到平衡状态的标志是
2SO3(g)
(正反应放热)。下列能判断该反应达到平衡状态的标志是
A.容器中混合气体的密度保持不变 B.每消耗1molO2的同时生成1molSO3
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
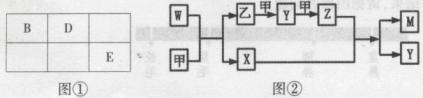
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图①,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可做火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②。
 |
回答下列问题:
(1)Z的化学式为 ;
(2)E的单质与水反应的离子方程式为 ;
(3)W8空气燃料电池是一种碱性燃料电池,电解质溶液是20﹪~30﹪的KOH溶液。W8空气燃料电池放电时,正极反应式为 ,负极反应式为 ;
(4)将一定量的A2、B2的混合气体放入1L闭密容器中,在500℃、2×107pa下达到平衡。测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol。则该条件下A2的平衡转化率为 ,该温度下的平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com