


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
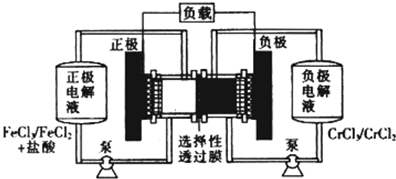
| A、充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电肘,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D、放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1mol.L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:CH2CH2 |
B、碳正离 中质子数与电子数之比值为3:2 中质子数与电子数之比值为3:2 |
| C、钙离子的基态电子排布比:1s22s22p63s23p6 |
| D、NaHCO3水解反应的离子方程式:HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.
已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铜屑加入FeCl3溶液中:Fe3++Cu=Fe2++Cu2+; |
| B、向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ |
| C、向硫酸铜加入过量氨水中:Cu2++4NH3=[Cu(NH3)4]2+ |
| D、少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com