

分析 (1)金刚石是原子晶体,每个碳原子形成4个共价键,导致金刚石为空间网状结构;
(2)NaCl是离子晶体,氯化钠晶胞中钠离子、氯离子配位数都是6;
(3)CsCl是离子晶体,氯化铯晶胞中铯离子配位数是8;
(4)干冰是分子晶体,每个C原子连接两个O原子,其构成微粒是分子,其晶胞为面心立方晶胞.
解答 解:(1)金刚石是原子晶体,每个碳原子形成4个共价键,导致金刚石为空间网状结构,所以金刚石熔沸点较高,属于空间物质结构的是D,故选D;
(2)NaCl是离子晶体,氯化钠晶胞中钠离子、氯离子配位数都是6,符合条件的为A,故选A;
(3)CsCl的构成微粒是阴阳离子,所以是离子晶体,氯化铯晶胞中铯离子配位数是8,符合条件的是C,故答案为:C;离子;
(4)干冰的构成微粒是分子,所以是分子晶体,每个C原子连接两个O原子,其构成微粒是分子,其晶胞为面心立方晶胞,符合条件的是B,故答案为:B;分子.
点评 本题考查常见晶体结构,侧重考查学生分析判断及空间想象能力,熟悉常见物质结构及构成微粒,注意金刚石中碳原子成键方式及组成的碳环,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
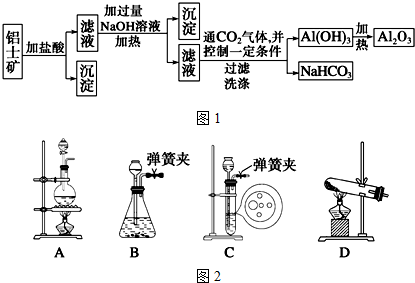
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R表示烃基,R和R表示烃基或氢)
(R表示烃基,R和R表示烃基或氢) .
. (任写一种).
(任写一种). .
. 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2+CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2+CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质都能在O2中燃烧生成过氧化物 | |
| B. | 从Li到Cs,密度越来越大,熔点越来越低 | |
| C. | 单质都可以保存在煤油中 | |
| D. | 单质都是强还原剂,与水反应都生成强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )的合成路线如下:
)的合成路线如下: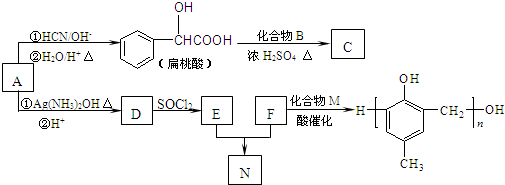
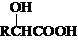
 $\stackrel{R′OH}{→}$RCOOR′(R、R′代表烃基)
$\stackrel{R′OH}{→}$RCOOR′(R、R′代表烃基) .
.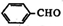 +2Ag(NH3)2OH$\stackrel{水浴加热}{→}$
+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$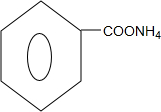 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.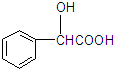 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有13种,写出其中一种含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体共有13种,写出其中一种含亚甲基(-CH2-)的同分异构体的结构简式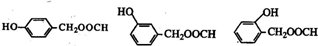 .
. .
. +
+ →
→ +HCl.
+HCl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com