
| ĪļÖŹ | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| ·Šµć/”ę | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
·ÖĪö £Ø1£©Éś²śĘÕĶز£Į§µÄÖ÷ŅŖŌĮĻÓŠ£ŗSiO2”¢Na2CO3ŅŌ¼°CaCO3£»·“Ó¦ĻņÉś³ÉøüĪȶØĪļÖŹµÄ·½Ļņ½ųŠŠ£»
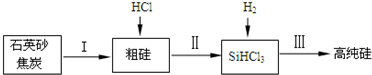
£Ø2£©¢ŁŹÆӢɰÓė½¹Ģæ·“Ó¦µĆµ½SiÓėCO£¬“Ö¹čÓėHCl·“Ó¦µĆµ½SiHCl3ÓėĒāĘų£¬×īŗóŌŁÓĆĒāĘų»¹ŌSiHCl3µĆµ½øß“æ¶Č¹č£»
¢Ś³Į½µ³żČ„øß·ŠµćµÄ¹č£¬ŌŚæÕĘųÖŠĄäÄżĖłµĆŅŗĢåµÄ·ŠµćÓ¦øßÓŚæÕĘųµÄ·Šµć£¬Ö÷ŅŖ·ŠµćĻą¶Ō½ĻøßµÄSiCl4”¢SiHCl3£¬¶žÕß·Šµć¾łµĶÓŚĖ®µÄ·Šµć£¬æÉŅŌĄūÓĆĖ®Ō”¼ÓČČ£»
¢ŪSiHCl3¼«Ņ×Ė®½ā£¬ĘäĶźČ«Ė®½āÉś³ÉŌ¹čĖį”¢ĒāĘųÓėHCl£®
½ā“š ½ā£ŗ£Ø1£©Éś²śĘÕĶز£Į§µÄÖ÷ŅŖŌĮĻÓŠ£ŗSiO2”¢Na2CO3ŅŌ¼°CaCO3£»Ģ¼ĖįĖįŠŌĒæÓŚ¹čĖį£¬µ«øßĪĀĻĀ¶žŃõ»Æ¹čÓėĢ¼ĖįÄĘ·“Ӧɜ³É¹čĖįÄĘÓė¶žŃõ»ÆĢ¼£¬ĖµĆ÷øßĪĀĻĀNa2SiO3µÄĪČ¶ØŠŌ±ČNa2CO3Ē棬
¹Ź“š°øĪŖ£ŗCaCO3£»øßĪĀĻĀNa2SiO3µÄĪČ¶ØŠŌ±ČNa2CO3Ē棻
£Ø2£©¢ŁŹÆӢɰÓė½¹Ģæ·“Ó¦µĆµ½SiÓėCO£¬“Ö¹čÓėHCl·“Ó¦µĆµ½SiHCl3ÓėĒāĘų£¬×īŗóŌŁÓĆĒāĘų»¹ŌSiHCl3µĆµ½øß“æ¶Č¹č£¬·“Ó¦¢ņµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗSi+3HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$SiHCl3+H2£¬·“Ó¦¢óµÄ»Æѧ·½³ĢŹ½£ŗ£¬
¹Ź“š°øĪŖ£ŗSi+3HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$SiHCl3+H2£»SiHCl3+H2$\frac{\underline{\;øßĪĀ\;}}{\;}$Si+3HCl£»
¢Ś³Į½µ³żČ„øß·ŠµćµÄ¹č£¬ŌŚæÕĘųÖŠĄäÄżĖłµĆŅŗĢåµÄ·ŠµćÓ¦øßÓŚæÕĘųµÄ·Šµć£¬Ö÷ŅŖ·ŠµćĻą¶Ō½ĻøßµÄSiCl4”¢SiHCl3£¬¶žÕß·Šµć¾łµĶÓŚĖ®µÄ·Šµć£¬æÉŅŌĄūÓĆĖ®Ō”¼ÓČČ£¬ŹÜČČ¾łŌČ£¬
¹Ź“š°øĪŖ£ŗSi£»SiCl4”¢SiHCl3£»D£»
¢ŪSiHCl3¼«Ņ×Ė®½ā£¬ĘäĶźČ«Ė®½āÉś³ÉŌ¹čĖį”¢ĒāĘųÓėHCl£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗSiHCl3+4H2O=H4SiO4+H2”ü+3HCl£¬
¹Ź“š°øĪŖ£ŗSiHCl3+4H2O=H4SiO4+H2”ü+3HCl£®
µćĘĄ ±¾ĢāŹĒ¶Ō»Æѧ¼¼ŹõµÄ漲飬Éę¼°¹čĖįŃĪ¹¤Ņµ”¢¹čµÄÖʱøÓėĢį“棬עŅā¶Ō»ł“”ÖŖŹ¶µÄĄķ½āÕĘĪÕ£®


 æŚĖćĢāæؼÓÓ¦ÓĆĢā¼ÆѵĻµĮŠ“š°ø
æŚĖćĢāæؼÓÓ¦ÓĆĢā¼ÆѵĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
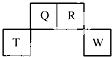 ¶ĢÖÜĘŚŌŖĖŲQ”¢R”¢T”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠTĖł“¦µÄÖÜĘŚŠņŹżÓėÖ÷×åŠņŹżĻąµČ£¬
¶ĢÖÜĘŚŌŖĖŲQ”¢R”¢T”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠTĖł“¦µÄÖÜĘŚŠņŹżÓėÖ÷×åŠņŹżĻąµČ£¬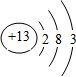 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £¬Ī„±³ĮĖÅŻĄū²»ĻąČŻŌĄķ£®
£¬Ī„±³ĮĖÅŻĄū²»ĻąČŻŌĄķ£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | MnO2ÓėÅØŃĪĖį·“Ó¦ÖĘCl2£ŗMnO2+4HCl$\frac{\underline{\;\;”÷\;\;}}{\;}$Mn2++2Cl-+Cl2”ü+2H2O | |
| B£® | ĀČ»ÆĢśČÜŅŗµĪ¼Óµ½·ŠĖ®ÖŠµĆµ½Fe£ØOH£©3 ½ŗĢå£ŗFe3++3H2OØTFe£ØOH£©3”ż+3H+ | |
| C£® | ĢśČÜÓŚŃĪĖį²śÉśH2£ŗ2Fe+6H+ØT2Fe3++3H2”ü | |
| D£® | Ca£ØHCO3£©2ČÜŅŗÓėÉŁĮæNaOHČÜŅŗ·“Ó¦£ŗHCO3-+Ca2++OH-ØTCaCO3”ż+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
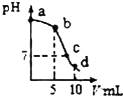 25”ꏱ£¬Ļņ10mL0.2mol•L-1NaCNČÜŅŗÖŠ¼ÓČė0.2mol•L-1ŃĪĖį£¬ČÜŅŗpHĖę¼ÓČėŃĪĖįµÄĢå»ż±ä»ÆĒéæöČēČēĶ¼ĖłŹ¾£®£¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©ŅŃÖŖ£ŗKa£ØHCN£©=6.4”Į10-10£®
25”ꏱ£¬Ļņ10mL0.2mol•L-1NaCNČÜŅŗÖŠ¼ÓČė0.2mol•L-1ŃĪĖį£¬ČÜŅŗpHĖę¼ÓČėŃĪĖįµÄĢå»ż±ä»ÆĒéæöČēČēĶ¼ĖłŹ¾£®£¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©ŅŃÖŖ£ŗKa£ØHCN£©=6.4”Į10-10£®| A£® | aµćŹ±£¬CN-Ąė×ÓÅØ¶Č“óÓŚĘäĖūµć | B£® | bµćŹ±£¬c£ØHCN£©£¾c£ØCN-£© | ||
| C£® | cµćŹ±£¬c£ØNa+£©=c£ØCl-£©+c£ØCN-£© | D£® | dµćŹ±£¬ČÜŅŗµÄc£ØH+£©”Ö8”Į10-5mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
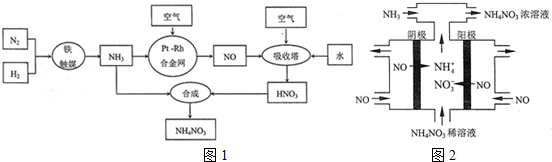
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2O2£Øs£©ÓėCO2£Øg£©·“Ó¦Ź±£¬·Å³ö226kJČČĮæ | |
| B£® | COµÄČ¼ÉÕČČĪŖ”÷H=-566kJ/mol | |
| C£® | CO£Øg£©ÓėNa2O2 £ØS£©·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗNa2O2£Øs£©+CO£Øg£©ØTNa2CO3£Øs£©”÷H=-509kJ•mol-1 | |
| D£® | 2Na2O2£Øs£©+2CO2£Øg£©ØT2Na2CO3£Øs£©+O2£Øg£©”÷H=-452kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com