
”¾ĢāÄæ”æ»ÆŗĻĪļA£Ø½öŗ¬ČżÖÖŌŖĖŲ£¬Ä¦¶ūÖŹĮæĪŖ198g”¤mol£1£©¾ßÓŠøߊ§µÄĻū¶¾×÷ÓĆ£¬ŹĒŅ»ÖÖŠĀŠĶ·ĒµŖøߊ§Ļū¶¾¼Į”£ĪŖĢ½¾æ»ÆŗĻĪļAµÄ×é³ÉÓėŠŌÖŹ£¬Éč¼Ę²¢Ķź³ÉŅŌĻĀŹµŃé£ŗČ”3. 96g»ÆŗĻĪļAČÜÓŚĖ®ÖŠ£¬Ņ»¶ĪŹ±¼äŗóČ«²æ×Ŗ»ÆĪŖB£ØŗģŗÖÉ«³Įµķ£©”¢C£ØŅ»ÖÖ¼ī£©ŗĶĘųĢåµ„ÖŹD£ØæÉŹ¹“ų»šŠĒµÄľĢõø“Č¼£©£¬ĻņČÜŅŗÖŠ¼ÓČė100mL 0.6mol/LĻ”ĮņĖį£¬ŌŁ¼ÓČėŗ¬ÓŠ0.08mol KOHµÄČÜŅŗ£¬Ē”ŗĆĶźČ«·“Ó¦”£¹żĀĖ£¬½«³ĮµķĻ“µÓŗó³ä·Ö×ĘÉÕ£¬µĆµ½ŗģ×ŲÉ«¹ĢĢå·ŪÄ©1.60g”£½«ĖłµĆČÜŅŗŌŚŅ»¶ØĢõ¼žĻĀÕō·¢æɵƵ½Ņ»ÖÖ“æ¾»µÄ²»ŗ¬½į¾§Ė®µÄŃĪ”£
£Ø1£©»ÆŗĻĪļAĖłŗ¬ÓŠµÄŌŖĖŲ£ŗ_______________£ØÓĆŌŖĖŲ·ūŗűķŹ¾£©”£
£Ø2£©»ÆŗĻĪļAÓėH2O·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ__________________”£
£Ø3£©»ÆŗĻĪļAæÉÓÉFeCl3ŗĶKClOŌŚĒæ¼īŠŌĢõ¼žĻĀÖĘµĆ£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ_________________”£
”¾“š°ø”æK ”¢ Fe ”¢O 4FeO42£+10H2O£½4Fe(OH)3”ż+3O2”ü+ 8OH- 2Fe3+ + 3ClO- + 10OH- = 2FeO42£+3Cl + 5H2O (»ņ2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42£+3Cl + 5H2O)
”¾½āĪö”æ
AŌŚĖ®ČÜŅŗÖŠ²»ĪČ¶Ø£¬Ņ»¶ĪŹ±¼äŗó×Ŗ»ÆĪŖŗģŗÖÉ«³Įµķ£¬Ķ¬Ź±²śÉśŅ»ÖÖĘųĢåµ„ÖŹ£¬æÉŹ¹“ų»šŠĒµÄľĢõø“Č¼ĪŖO2£¬øĆŗģŗÖÉ«³ĮµķĪŖFe(OH)3£»æÉĶĘÖŖAŗ¬ÓŠFeŌŖĖŲ”£AµÄ»ÆŗĻĪļÓĆĮņĖįČܽā£¬ŌŁ¼ÓČė¼ÓKOH£¬Éś³É³Įµķ×ĘÉÕµĆµ½ŗģ×ŲÉ«¹ĢĢå·ŪÄ©1.60gĪŖŃõ»ÆĢś£¬ÓÉĢśŌŖĖŲŹŲŗćæÉŅŌÖŖµĄ£¬3. 96g»ÆŗĻĪļAŗ¬Ģś£ŗ![]() ”Į2=0.02mol£¬²»ŗ¬½į¾§Ė®µÄŃĪĪŖĮņĖį¼Ų£¬øł¾Ż¼ŲŌŖĖŲŹŲŗć£¬3. 96g »ÆŗĻĪļAÖŠŗ¬¼Ų0.6mol/L”Į0.1L”Į2-0.08mol=0.04mol£¬3. 96g»ÆŗĻĪļAÖŠŗ¬Ńõ£ŗ
”Į2=0.02mol£¬²»ŗ¬½į¾§Ė®µÄŃĪĪŖĮņĖį¼Ų£¬øł¾Ż¼ŲŌŖĖŲŹŲŗć£¬3. 96g »ÆŗĻĪļAÖŠŗ¬¼Ų0.6mol/L”Į0.1L”Į2-0.08mol=0.04mol£¬3. 96g»ÆŗĻĪļAÖŠŗ¬Ńõ£ŗ![]() =0.08mol£¬¹Ź¼Ų”¢Ģś”¢ŃõµÄøöŹż±ČĪŖ£ŗ0.04mol:0.02mol:0.08mol=2:1:4£¬¹ŹAµÄ»ÆѧŹ½ĪŖ£ŗK2FeO4£»øßĢśĖį¼ŲÓėĖ®·“Ӧɜ³ÉŃõĘųŗĶFe(OH)3”¢ĒāŃõ»Æ¼Ų£¬·“Ó¦·½³ĢŹ½ĪŖ4K2FeO4+10H2O£½4Fe(OH)3”ż+3O2”ü+ 8KOH£¬¾Ż“Ė½ā“š”£
=0.08mol£¬¹Ź¼Ų”¢Ģś”¢ŃõµÄøöŹż±ČĪŖ£ŗ0.04mol:0.02mol:0.08mol=2:1:4£¬¹ŹAµÄ»ÆѧŹ½ĪŖ£ŗK2FeO4£»øßĢśĖį¼ŲÓėĖ®·“Ӧɜ³ÉŃõĘųŗĶFe(OH)3”¢ĒāŃõ»Æ¼Ų£¬·“Ó¦·½³ĢŹ½ĪŖ4K2FeO4+10H2O£½4Fe(OH)3”ż+3O2”ü+ 8KOH£¬¾Ż“Ė½ā“š”£
AŌŚĖ®ČÜŅŗÖŠ²»ĪČ¶Ø£¬Ņ»¶ĪŹ±¼äŗó×Ŗ»ÆĪŖŗģŗÖÉ«³Įµķ£¬Ķ¬Ź±²śÉśŅ»ÖÖĘųĢåµ„ÖŹ£¬øĆŗģŗÖÉ«³ĮµķĪŖFe(OH)3£»æÉĶĘÖŖAŗ¬ÓŠFeŌŖĖŲ”£AµÄ»ÆŗĻĪļÓĆĮņĖįČܽā£¬ŌŁ¼ÓČė¼ÓKOH£¬Éś³É³Įµķ×ĘÉÕµĆµ½ŗģ×ŲÉ«¹ĢĢå·ŪÄ©1.60gĪŖŃõ»ÆĢś£¬ÓÉĢśŌŖĖŲŹŲŗćæÉŅŌÖŖµĄ£¬3. 96g»ÆŗĻĪļAŗ¬Ģś£ŗ![]() ”Į2=0.02mol£¬²»ŗ¬½į¾§Ė®µÄŃĪĪŖĮņĖį¼Ų£¬øł¾Ż¼ŲŌŖĖŲŹŲŗć£¬3. 96g »ÆŗĻĪļAÖŠŗ¬¼Ų0.6mol/L”Į0.1L”Į2-0.08mol=0.04mol£¬3. 96g»ÆŗĻĪļAÖŠŗ¬Ńõ£ŗ
”Į2=0.02mol£¬²»ŗ¬½į¾§Ė®µÄŃĪĪŖĮņĖį¼Ų£¬øł¾Ż¼ŲŌŖĖŲŹŲŗć£¬3. 96g »ÆŗĻĪļAÖŠŗ¬¼Ų0.6mol/L”Į0.1L”Į2-0.08mol=0.04mol£¬3. 96g»ÆŗĻĪļAÖŠŗ¬Ńõ£ŗ![]() =0.08mol£¬¹Ź¼Ų”¢Ģś”¢ŃõµÄøöŹż±ČĪŖ£ŗ0.04mol:0.02mol:0.08mol=2:1:4£¬¹ŹAµÄ»ÆѧŹ½ĪŖ£ŗK2FeO4£»
=0.08mol£¬¹Ź¼Ų”¢Ģś”¢ŃõµÄøöŹż±ČĪŖ£ŗ0.04mol:0.02mol:0.08mol=2:1:4£¬¹ŹAµÄ»ÆѧŹ½ĪŖ£ŗK2FeO4£»
(1)ÓÉÉĻŹö·ÖĪöæÉŅŌÖŖµĄ£¬AµÄ»ÆѧŹ½ĪŖ£ŗK2FeO4£»Ėłŗ¬ÓŠµÄŌŖĖŲĪŖ£ŗK ”¢Fe ”¢O£¬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗK ”¢Fe ”¢O£»
(2) øßĢśĖį¼ŲÓėĖ®·“Ӧɜ³ÉŃõĘųŗĶFe(OH)3”¢ĒāŃõ»Æ¼Ų£¬·“Ó¦·½³ĢŹ½ĪŖ4K2FeO4+10H2O£½4Fe(OH)3”ż+3O2”ü+ 8KOH£¬ŌņĄė×Ó·½³ĢŹ½ĪŖ£ŗ4FeO42£+10H2O£½4Fe(OH)3”ż+3O2”ü+ 8OH-£¬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗ4FeO42£+10H2O£½4Fe(OH)3”ż+3O2”ü+ 8OH-£»
£Ø3£©øßĢśĖį¼ŲæÉÓÉFeCl3ŗĶKClOŌŚĒæ¼īŠŌĢõ¼žĻĀÖĘµĆ£¬Čż¼ŪĢśĄė×Ó±»“ĪĀČĖį¼ŲŃõ»ÆĪŖøßĢśĖį¼Ų£¬“ĪĀČĖį¼Ų±»»¹ŌĪŖĀČ»Æ¼Ų£¬Ķ¬Ź±Éś³ÉĖ®£¬Ęä·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ2Fe3+ + 3ClO- + 10OH- =2FeO42£+3Cl + 5H2O£¬
Ņņ“Ė£¬±¾ĢāÕżČ·“š°øŹĒ£ŗ2Fe3+ + 3ClO- + 10OH- = 2FeO42£+3Cl + 5H2O”£


 æŖŠÄæģĄÖ¼ŁĘŚ×÷ŅµŹī¼Ł×÷ŅµĪ÷°²³ö°ęÉēĻµĮŠ“š°ø
æŖŠÄæģĄÖ¼ŁĘŚ×÷ŅµŹī¼Ł×÷ŅµĪ÷°²³ö°ęÉēĻµĮŠ“š°ø ĆūĢāѵĮ·ĻµĮŠ“š°ø
ĆūĢāѵĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻņĢśŗĶŃõ»ÆĢśµÄ»ģŗĻĪļÖŠ¼ÓČė500mL0.20mol”¤L£1Ļ”ŃĪĖįŗóĒ”ŗĆĶźČ«Čܽā£¬µĆµ½Ö»ŗ¬Ņ»ÖÖ½šŹōĄė×ÓµÄĒ³ĀĢÉ«ČÜŅŗ£¬²¢ŹÕ¼Æµ½448mLĒāĘų£Ø±ź×¼×“æöĻĀ²ā¶Ø£©”£»Ų“šĻĀĮŠĪŹĢā;
£Ø1£©·“Ó¦ŗóČÜŅŗÖŠµÄČÜÖŹĪŖ__________mol”£
£Ø2£©Ō»ģŗĻĪļÖŠµ„ÖŹĢśµÄÖŹĮæĪŖ___________g,Ńõ»ÆĢśµÄÖŹĮæĪŖ___________g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫SO2ĶØČėĘ·ŗģČÜŅŗÖŠ£¬ČÜŅŗĶŹÉ«£¬ĢåĻÖĮĖSO2µÄ
A.Ęư׊ŌB.Ńõ»ÆŠŌC.ĖįŠŌD.»¹ŌŠŌ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĻĀĮŠ×°ÖĆ½ųŠŠĻą¹ŲŹµŃ飬²Ł×÷ÕżČ·ĒŅÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ

A. ¼××°ÖĆ:³Ę30.0gNaOH¹ĢĢå B. ŅŅ×°ÖĆ:¹żĀĖ³żČ„ČÜŅŗÖŠµÄ²»ČÜŠŌŌÓÖŹ
C. ±ū×°ÖĆ:³żČ„CO2ÖŠ»ģÓŠµÄHClĘųĢå D. ¶”×°ÖĆ:ĪüŹÕŹµŃéŹŅÖĘNH3µÄĪ²Ęų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆCH4“߻ƻ¹ŌNOxæÉŅŌĻū³żµŖŃõ»ÆĪļµÄĪŪČ¾”£ĄżČē£ŗ
¢ŁCH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ¦¤H=574 kJ”¤mol1
4NO(g)+CO2(g)+2H2O(g) ¦¤H=574 kJ”¤mol1
¢ŚCH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ¦¤H=1 160 kJ”¤mol1
2N2(g)+CO2(g)+2H2O(g) ¦¤H=1 160 kJ”¤mol1
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. ÓÉ·“Ó¦¢ŁæÉĶĘÖŖ£ŗCH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l)””¦¤H=Q£¬Q>574 kJ”¤mol1
4NO(g)+CO2(g)+2H2O(l)””¦¤H=Q£¬Q>574 kJ”¤mol1
B. µČĪļÖŹµÄĮæµÄ¼×Ķé·Ö±š²Ī¼Ó·“Ó¦¢Ł”¢¢Ś£¬·“Ó¦×ŖŅʵĵē×ÓŹż²»Ķ¬
C. ČōÓƱź×¼×“æöĻĀ4.48 L CH4»¹ŌNO2ÖĮN2£¬Ōņ·Å³öµÄČČĮæĪŖ173.4 kJ
D. ČōÓƱź×¼×“æöĻĀ4.48 L CH4»¹ŌNO2ÖĮN2£¬ŌņÕūøö¹ż³ĢÖŠ×ŖŅʵĵē×Ó×ÜĪļÖŹµÄĮæĪŖ1.6 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾Ż°±Ęų»¹ŌŃõ»ÆĶµÄ·“Ó¦£¬æÉÉč¼Ę²ā¶ØĶŌŖĖŲĻą¶ŌŌ×ÓÖŹĮæAr(Cu)£Ø½üĖĘÖµ£©µÄŹµŃ锣ĻČ³ĘĮæ·“Ó¦ĪļŃõ»ÆĶµÄÖŹĮæm(CuO)£¬·“Ó¦ĶźČ«ŗó²ā¶ØÉś³ÉĪļĖ®µÄÖŹĮæm(H2O)£¬ÓÉ“Ė¼ĘĖćAr(Cu)”£ĪŖ“Ė£¬Ģį¹©µÄŹµŃéŅĒĘ÷¼°ŹŌ¼ĮČēĻĀ£Øøł¾ŻŠčŅŖæÉÖŲø“Ń”ÓĆ£¬¼ÓČėµÄNH4ClÓėCa(OH)2µÄĮæ×ćŅŌ²śÉśŹ¹CuOĶźČ«»¹ŌµÄ°±Ęų£©£ŗ
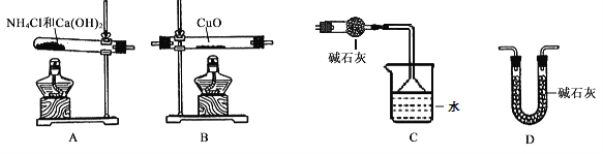
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©°±Ęų»¹Ō³ćČČŃõ»ÆĶµÄ»Æѧ·½³ĢŹ½ĪŖ________________________”£
£Ø2£©“ÓĖłĢį¹©µÄŅĒĘ÷¼°ŹŌ¼ĮÖŠŃ”Ōń²¢×é×°±¾ŹµŃéµÄŅ»Ģ×ŗĻĄķ”¢¼ņµ„µÄ×°ÖĆ£¬°“ĘųĮ÷·½ĻņµÄĮ¬½ÓĖ³ŠņĪŖ£ØÓĆĶ¼ÖŠ±ź×¢µÄ×ÖÄø±ķŹ¾£©A”ś________________________”£
£Ø3£©ŌŚ±¾ŹµŃéÖŠ£¬Ź¹²ā¶Ø½į¹ūAr(Cu)Ę«“óµÄŹĒ________________________£ØĢīŠņŗÅ£©”£
¢ŁCuOĪ“ĶźČ«·“Ó¦ ¢ŚCuO²»øÉŌļ
¢ŪCuOÖŠ»ģÓŠ²»·“Ó¦µÄŌÓÖŹ ¢ÜNH4ClÓėCa(OH)2»ģŗĻĪļ²»øÉŌļ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”湤ŅµÉĻÓĆÄŃČÜÓŚĖ®µÄĢ¼ĖįļČ£ØSrCO3£©·ŪÄ©ĪŖŌĮĻ£Øŗ¬ÉŁĮæ±µŗĶĢśµÄ»ÆŗĻĪļ£©Öʱøøß“æĮłĖ®ĀČ»ÆļČ¾§Ģå£ØSrCl2”¤6H2O£©£¬Ęä¹ż³ĢĪŖ£ŗ

ŅŃÖŖ£ŗ¢ń£®ÓŠ¹ŲĒāŃõ»ÆĪļ³ĮµķµÄpH£ŗ
ĒāŃõ»ÆĪļ | Fe(OH)3 | Fe(OH)2 |
æŖŹ¼³ĮµķµÄpH | 1.5 | 6.5 |
³ĮµķĶźČ«µÄpH | 3.7 | 9.7 |
¢ņ£®SrCl2”¤6H2O ¾§ĢåŌŚ61”ꏱæŖŹ¼Ź§Č„½į¾§Ė®£¬100”ꏱŹ§Č„Č«²æ½į¾§Ė®”£
Ēė»Ų“š£ŗ
£Ø1£©Š“³öĢ¼ĖįļČÓėŃĪĖį·“Ó¦µÄĄė×Ó·½³ĢŹ½_______________”£
£Ø2£©ŌŚ²½Öč¢ŪÖŠ£¬ŠčŅŖ½«ČÜŅŗµÄpHÓÉ1µ÷½ŚÖĮ3.7ŅŌÉĻ£¬ŹŹŅĖŃ”ÓƵďŌ¼ĮĪŖ__________£ØŠ“Ņ»ÖÖ£©”£
£Ø3£©¹ŲÓŚÉĻŹöĮ÷³ĢÖŠø÷²½ÖčµÄĖµ·Ø£¬ÕżČ·µÄŹĒ_____________”£
A£®µ÷½ŚpHŗó¼ÓČČÖ󷊵ÄŌŅņŹĒ³żČ„H2O2£¬²¢±ÜĆāÉś³ÉFe(OH)3½ŗĢå
B£®²½Öč¢Ü°üĄØÓĆ60”ęµÄČČĖ®Ō”¼ÓČČÕō·¢µ½ČÜŅŗ±ķĆę³öĻÖ¾§Ä¤”¢ĄäČ“½į¾§
C£®æÉŅŌĶعż¼Óæģ½į¾§ĖŁĀŹµÄ·½·ØĄ“µĆµ½½Ļ“óæÅĮ£µÄSrCl2”¤6H2O ¾§Ģå
D£®²½Öč¢ŽøÉŌļSrCl2”¤6H2O¾§ĢåæÉŅŌ²ÉÓĆ¼õŃ¹øÉŌļ
£Ø4£©ĪŖĮĖ²ā¶ØĖłµĆSrCl2”¤6H2O¾§ĢåѳʷµÄ“æ¶Č£¬Éč¼ĘĮĖČēĻĀ·½°ø£ŗ³ĘČ”1.40gѳʷČܽāÓŚŹŹĮæĖ®ÖŠ£¬ĻņĘäÖŠ¼ÓČėŗ¬AgNO3 2.38gµÄAgNO3ČÜŅŗ£ØČÜŅŗÖŠ³żCl£Ķā£¬²»ŗ¬ĘäĖüÓėAg+·“Ӧɜ³É³ĮµķµÄĄė×Ó£©£¬Cl£¼“±»Č«²æ³Įµķ”£Č»ŗóÓĆŗ¬Fe3+µÄČÜŅŗ×÷ÖøŹ¾¼Į£¬ÓĆ0.200mol”¤L£1µÄNH4SCN±ź×¼ČÜŅŗµĪ¶ØŹ£ÓąµÄAgNO3£¬Ź¹Ź£ÓąµÄAg+ŅŌAgSCN°×É«³ĮµķµÄŠĪŹ½Īö³ö£¬µ±_______________Ź±“ļµ½µĪ¶ØÖÕµć£¬ÓĆČ„NH4SCNČÜŅŗ20.0mL£¬ŌņŌSrCl2”¤6H2O¾§ĢåµÄ“æ¶ČĪŖ_________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ723KŹ±£¬2SO2£Øg£©+O2£Øg£©![]() 2SO3£Øg£©”÷H=©QkJ/mol£¬ŌŚĻąĶ¬Ģõ¼žĻĀ£¬ĻņŅ»ĆܱÕČŻĘ÷ÖŠĶØČė2mol SO2ŗĶ1mol O2£¬“ļµ½Ę½ŗāŹ±·Å³öµÄČČĮæĪŖQ1kJ£»ĻņĮķŅ»Ģå»żĻąĶ¬µÄĆܱÕČŻĘ÷ÖŠĶØČė1mol SO2ŗĶ0.5mol O2£¬“ļµ½Ę½ŗāŹ±·Å³öµÄČČĮæĪŖQ2kJ”£ŌņQ1”¢Q2”¢QĀś×ćµÄ¹ŲĻµŹĒ£Ø £©
2SO3£Øg£©”÷H=©QkJ/mol£¬ŌŚĻąĶ¬Ģõ¼žĻĀ£¬ĻņŅ»ĆܱÕČŻĘ÷ÖŠĶØČė2mol SO2ŗĶ1mol O2£¬“ļµ½Ę½ŗāŹ±·Å³öµÄČČĮæĪŖQ1kJ£»ĻņĮķŅ»Ģå»żĻąĶ¬µÄĆܱÕČŻĘ÷ÖŠĶØČė1mol SO2ŗĶ0.5mol O2£¬“ļµ½Ę½ŗāŹ±·Å³öµÄČČĮæĪŖQ2kJ”£ŌņQ1”¢Q2”¢QĀś×ćµÄ¹ŲĻµŹĒ£Ø £©
A£®Q2=![]() B£®Q2£¾
B£®Q2£¾![]() C£®Q2£¼Q1£¼Q D£®Q=Q1£¾Q2
C£®Q2£¼Q1£¼Q D£®Q=Q1£¾Q2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪŽĶĮŌŌÅąÓƵÄÓŖŃųŅŗ£¬ŅŖĒóKCl”¢K2SO4ŗĶNH4ClČżÖÖ¹ĢĢåŌĮĻµÄĪļÖŹµÄĮæÖ®±ČĪŖ1£ŗ4£ŗ8£®ČōÅäÖĆøĆÓŖŃųŅŗ£¬Č”214gNH4Cl£¬ŌņŠčKClŗĶK2SO4µÄÖŹĮæ·Ö±šĪŖ£Ø £©
A.53.5gŗĶ214gB.37.25gŗĶ348g
C.74.5gŗĶ696gD.149gŗĶ696g
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com