
| A. | 3 mol H2和1 mol N2 | |
| B. | 2 mol NH3和1 mol N2 | |
| C. | 2 mol N2和3 mol H2 | |
| D. | 0.1 mol NH3、0.9 mol N2、2.85 mol H2 |
分析 通入2mol 氨气,在一定温度下发生反应:2NH3?N2+3H2,达平衡时,N2的物质的量分数为a%,维持容器的体积和温度不变,要使达到平衡,容器内N2的物质的量分数仍为a%即互为等效平衡,将物质全部靠到一边进行极限转化,再与原反应进行比较来判断,若各物质与原来相等,则等效,否则不等效,据此分析解答.
解答 解:A、采用极限分析法,3molH2和1molN2反应生成NH3,假如反应完全,就会生成2molNH3,这和题目开始完全一样,则等效,故A正确;
B、2molNH3和1molN2,这和题目开始不一样,不等效,故B错误;
C、采用极限分析法,2molN2和3molH2反应生成NH3,假如反应完全,就会生成2molNH3,还有剩余的1molN2,这和题目开始不一样,不等效,故C错误;
D、采用极限分析法,0.1 mol NH3、0.9 mol N2、2.85 mol H2反应生成NH3,假如全部靠到一边,为1.9mol NH3、0.15 mol H2,这和题目开始一样,不等效,故D错误;
故选:A.
点评 本题考查化学平衡的计算、等效平衡等,难度中等,明确极性转化即可解答,注意等效平衡的建立是解答的关键.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | Fe和稀HNO3 | C. | Cu和FeCl3溶液 | D. | Na2CO3和稀HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在实验室里制取乙烯的反应为:
在实验室里制取乙烯的反应为: $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O
$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C14H18N2O3 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
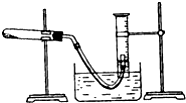 某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:
某学生利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量.实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com