
分析 只用试管和胶头滴管,不用任何化学试剂就可以鉴别的物质可以采用相互滴加的方法检验,滴加顺序不同,现象不同的可以鉴别,以此来解答.
解答 解:①将AlCl3溶液滴入NaOH溶液中,先没有明显现象,后生成白色沉淀,将NaOH溶液滴入AlCl3溶液中,先生成白色沉淀,后白色沉淀溶解,二者现象不同,可鉴别,故①正确;
②无论是Ca(HCO3)2溶液滴入NaOH溶液中,还是NaOH溶液滴入Ca(HCO3)2溶液中,都产生白色沉淀,二者现象相同,不能鉴别,故②错误;
③NaAlO2溶液滴入盐酸中,开始无现象,若将盐酸滴入NaAlO2溶液中,开始生成沉淀后溶解,二者现象不同,可鉴别,故③正确;
④Al2(SO4)3溶液和氨水的反应与量有关,改变滴定顺序均生成白色沉淀,可鉴别,故④错误;
故答案为:①③.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意与量有关的离子反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6min时,c(H2O2)=0.20mol/L | |
| B. | 反应至6min时,H2O2分解了40% | |
| C. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| D. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编 号 | ① | ② | ③ | ④ |
| 组成A的物质的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4、C3H4 | B. | C2H4、C3H8、C2H6 | C. | C2H2、C2H4、C3H6 | D. | C2H2、C2H6、C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化,再滴加KSCN溶液后有红色物质生成,则原溶液中一定有Fe3+存在 | |
| B. | 加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO32-存在 | |
| C. | 用某溶液做焰色反应实验时火焰为黄色,则该溶液中一定有钠元素,可能有钾元素 | |
| D. | 分别含有Mg2+、Fe3+、Al3+、Cu2+、Fe2+和Na+的六种盐溶液,只用NaOH溶液是不能一次鉴别开的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
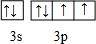 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、海水制镁、纤维素制火棉都包含化学变化 | |
| B. | 蛋白质、棉花、聚氯乙烯、淀粉都是自然界存在的天然高分子化合物 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界,这一完美结合现实与理论的化学系统模型,为全面了解并预测化学反应进程奠定了基础 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
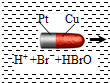 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )| A. | 铜为电池的正极 | |
| B. | 铂不断溶解 | |
| C. | 稀溴水为电解质溶液 | |
| D. | 电池工作时实现机械能向电能再向化学能转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com