
| A. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移电子的数目为7.5 NA | |
| B. | 16.2 g纤维素完全燃烧,产生CO2分子的数目约为0.6 NA | |
| C. | 电解饱和食盐水产生11.2 L H2,则产生OH-的数目为0.1 NA | |
| D. | 1 L 0.1 mol•L-1NaHCO3溶液中含有HCO3-的数目为0.1 NA |
分析 A、反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O转移15mol电子生成4mol氮气;
B、纤维素的最简式为C6H10O5,求出纤维素中含有的C6H10O5的物质的量,然后根据1molC6H10O5燃烧生成6mol二氧化碳来分析;
C、氢气所处的状态不明确;
D、HCO3-在溶液中既能电离又能水解.
解答 解:A、反应5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O转移15mol电子生成4mol氮气,故当生成28g氮气即1mol氮气时,转移3.75mol电子即3.75NA个,故A错误;
B、纤维素的最简式为C6H10O5,16.2g纤维素中含有的C6H10O5的物质的量为0.1mol,而1molC6H10O5燃烧生成6mol二氧化碳,故0.1molC6H10O5燃烧生成0.6mol二氧化碳即0.6NA个二氧化碳分子,故B正确;
C、氢气所处的状态不明确,故其物质的量无法计算,则阴极生成的氢氧根的个数无法计算,故C错误;
D、HCO3-在溶液中既能电离又能水解,故溶液中含有的HCO3-的个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和果糖分子式均为C6H12O6,均属于还原糖 | |
| B. | 淀粉和纤维素都属于多糖,其中每个葡萄糖单元包含三个羟基 | |
| C. | 糖类并不是都有甜味,有甜味的物质也不一定是糖类 | |
| D. | 葡萄糖具有多羟基醛的结构,属于最简单的单糖 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:填空题
(1)铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
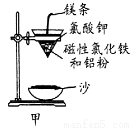
①某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 ;
②若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 ;
(2)现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,
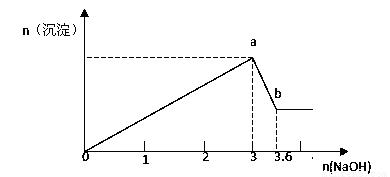
请计算出①a处沉淀的总物质的量 mol;
②c(FeCl3)= mol/L;③c(AlCl3)= mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 风力、化石燃料、水能都是一次能源 | |
| B. | 开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径 | |
| C. | 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源 | |
| D. | 用脱硫处理的煤代替原煤作燃料可以有效减少空气中CO2气体的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙 | B. | 碳酸钠 | C. | 氢氧化钾 | D. | 次氯酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸铜溶液中逐滴加入氨水至过量 | |
| B. | 向鸡蛋清溶液中逐滴加入饱和硫酸钠溶液至过量 | |
| C. | 向氢氧化铁胶体中逐滴加入盐酸至过量 | |
| D. | 向硫酸铝钾溶液中逐滴加入氢氧化钠溶液至过量 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:推断题
A~J是中学化学中常见的化学物质,它们之间的相互转化关系如下列框图所示(部分反应的产物未列出)。
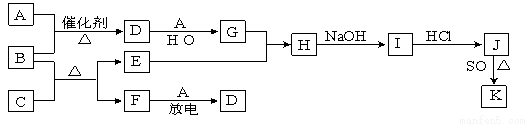
已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为 ;F的电子式为 。
(2)B和C反应的化学方程式为 。该反应中生成1molF时,转移的电子数为 mol
(3)E与G的稀溶液反应的离子方程式为: 。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:计算题
常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Br—Br | H—Br |
键能/(kJ·mol-1) | 436 | 193 | 366 |
请计算H2(g)+Br2(g)==2HBr(g)的反应热( )
A.+103 kJ·mol-1 B.+679 kJ·mol-1 C.-103 kJ·mol-1 D.+183 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com