
 2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。
2C(g)+xD(g),经5min达到平衡,此时生成2 mol C,测得D的平均反应速率为0.15 mol/(L·min),则平衡时A的物质的量浓度是____________;B的转化率是__________;x的值是___________。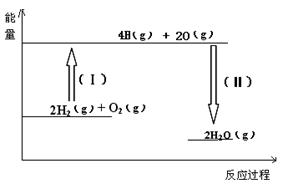
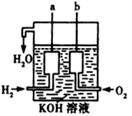


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:不详 题型:实验题
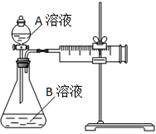
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
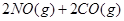

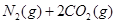 下列说法不正确的是
下列说法不正确的是A.升高温度可使该反应的逆反应速率降低 | B.使用高效催化剂可有效提高正反应速率 | C.反应达到平衡后,N0的反应速率保持恒定 | D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
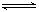 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
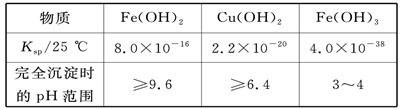
| A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 |
| B.向该溶液中加入适量氯水,并调节pH到3~4后过滤,可获得纯净的CuSO4溶液 |
| C.该溶液中c(SO)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 |
| D.在pH=5的溶液中Fe3+不能大量存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是| A.①④ | B.①③ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
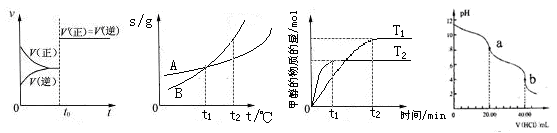 图4 图5 图6 图7
图4 图5 图6 图7查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
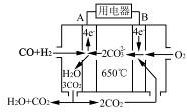
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。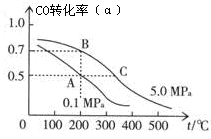
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com