
| A、蒸馏是分离提纯相互互溶的液态有机物的常用方法 |
| B、石油分馏可获得乙烯、丙烯和丁二烯 |
| C、通过煤的直接或间接液化,可以获得燃料油及多种化工原料 |
| D、重结晶法提纯苯甲酸时,杂质的溶解度很小或很大均易于除去 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从碘水中提取单质碘,不能用无水乙醇代替CCl4 |
| B、MgCl2溶液混有少量FeCl3,加足量Mg(OH)2调pH后过滤 |
| C、用广泛pH试纸测得0.10mol?L-1 NH4Cl溶液的pH=5.2 |
| D、CO2混有少量SO2,除杂试剂和方法为:酸性KMnO4溶液、浓硫酸,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的反应过程与能量关系可以用图表示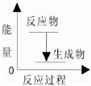 |
| B、若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解 |
| C、若将该反应设计成原电池,溶液中SO42-向Fe电极移动 |
| D、若将该反应设计成原电池,负极发生的反应是:Fe-2e=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原性:HF<HCl<HBr<HI |
| B、稳定性:NH3<SiH4 |
| C、氧化性:F2<Cl2<Br2<I2 |
| D、熔、沸点:H2O<H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、点燃,能燃烧的是矿物油 |
| B、测定沸点,有固定沸点的是矿物油 |
| C、加入水中,浮在水面上的是地沟油 |
| D、加入足量氢氧化钠溶液共热,不分层的是地沟油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com