
下列描述中正确的是

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
(I)原子半径:A<C<B<E<D
(II)原子的最外层电子数:A=D,C=E,A+B=C
(III)原子的核外电子层数:B=C=2A
(Ⅳ)F的+3价阳离子基态价电子排布为3d5
请回答:
(1)B原子的基态原子电子排布,所有能级均处于全充满或半充满状态,则B原子的电子排布式为 。
(2)甲是A、C两元素按原子个数比2∶1组成常见化合物,甲的VSEPR模型为 ,甲分子的立体构型为 。
(3)上述元素中,A、B、C、E、F五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1∶1∶2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝色的气体,则该复盐的化学式 。为检验复盐中某有色离子的存在,请写出检验的实验操作和现象 。
(4)F的+3价离子在碱性条件下可被NaClO氧化为+6价的含氧酸根离子,ClO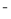 被还原为Cl
被还原为Cl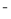 ,写出反应的离子方程式 。
,写出反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三(补习班)10月月考理综化学试卷(解析版) 题型:实验题
(16分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。

请回答下列问题:
(1)仪器中装入的试剂:B_________ 、D___________;
(2)连接好装置后应首先_________________________,(填写操作)
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是 _______________;在这两步之间还应进行的操作是____________________________
(4)写出反应过程中反应管E中的化学方程式:_______________ ,
(5)从实验中测得了下列数据
①空E管的质量a ; ②E管和WO3的总质量b ;③反应后E管和W粉的总质量c(冷却到室温称量);④反应前F管及内盛物的总质量d ;⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________;计算式2:Ar(W)=____________。
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液:c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—)
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列离子方程式表达正确的是
A.向漂白粉溶液中通入少量CO2的离子方程式: 2ClO-+CO2+H2O===2HClO+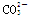
B.用铜为电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.50 mL 1mol/L的NaOH溶液中通入0.03 mol H2S:5OH-+3H2S=HS-+2S2-+5H2O
D.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+MgCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列说法正确的是
①乙烯的结构简式:CH2CH2
②HF的电子式: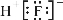
③HClO的结构式:H—O—Cl
④基态碳原子的价电子排布图: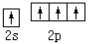
⑤基态Cr的价电子排布式:3d44s2
⑥斜长石KAlSi3O8的氧化物形式可表示为:K2O?Al2O3?6SiO2
A.①③ B.③④ C.④⑤ D.③⑥
查看答案和解析>>
科目:高中化学 来源:2015届吉林省长春外国语学校高三上学期期中理综化学试卷(解析版) 题型:选择题
电解法处理酸性含铬废水(主要含有Cr2O72—)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是
A.阳极反应为Fe-2e-===Fe2+
B.电解过程中溶液pH会升高
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2 mol Cr2O72—被还原
查看答案和解析>>
科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:填空题
(13分)高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
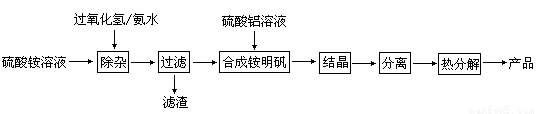
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(5)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com