
【题目】在m毫升b摩/升AlCl3溶液中加入等体积a摩/升NaOH溶液。
(1)当0<a≤3b时,生成Al(OH)3沉淀的物质的量是_______________。
(2)当 a=3b时, 生成沉淀 _______ 克
(3)当a,b满足___________条件时,无沉淀生成。
(4)当3b≤a<4b时,有沉淀生成,生成Al(OH)3沉淀的质量是__________
【答案】 ![]() 0.026 am 或0.078 bm a≥4b
0.026 am 或0.078 bm a≥4b ![]()
【解析】试题分析:(1)AlCl3和NaOH反应,3NaOH+AlCl3=Al(OH)3+3NaCl,当a≤3b时,反应中NaOH不足量,以NaOH为标准进行计算,
设生成Al(OH)3沉淀的物质的量为x mol。
3:1= m×10-3×a:x
解得 x= am/3000mol,
(2)当 a=3b时, AlCl3和NaOH的物质的量之比为1:3,二者恰好完全反应,
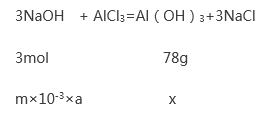
3:78= m×10-3×a:x
解得 x= 78am/3000g=0.026 am g
或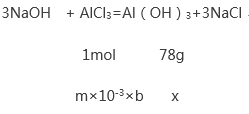
1:78= m×10-3×b:x
解得 x= 78bm/1000g=0.078 bm g
(3)AlCl3和NaOH反应生成Al(OH)3,Al(OH)3是两性氢氧化物,能够溶于过量的NaOH溶液,NaOH+Al(OH)3=NaAlO2+2H2O,
总方程式为4NaOH+AlCl=NaAlO2+3NaCl+2H2O,由方程式可得,

a:b=4:1
所以a=4b或a>4b;即a≥4b时没有沉淀。
(3)3b≤a<4b时,先有沉淀生成后又有部分沉淀溶解,铝离子部分以氢氧化铝沉淀的形式存在,部分以偏铝酸根离子的形式存在;设AlCl3转化为Al(OH)3的物质的量是xmol,则生成NaAlO2的AlCl3为(m×10-3b-x)mol,根据3NaOH+AlCl3=Al(OH)3+3NaCl,生成氢氧化铝沉淀消耗氢氧化钠3xmol,根据4NaOH+AlCl=NaAlO2+3NaCl+2H2O,生成偏铝酸钠消耗氢氧化钠4(m×10-3b-x)mol,3xmol+4(m×10-3b-x)mol= m×10-3×a,x= ![]() mol,所以氢氧化铝的质量是
mol,所以氢氧化铝的质量是![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)pC(g),在密闭容器中进行,如图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是( ) 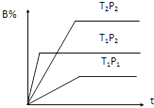
A.T1<T2、P1>P2、m+n>p,△H<0
B.T1>T2、P1<P2、m+n>p,△H>0
C.T1>T2、P1<P2、m+n<p,△H>0
D.T1<T2、P1>P2、m+n<p,△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为V2O5+xLi ![]() LixV2O5 . 下列说法中正确的是( )
LixV2O5 . 下列说法中正确的是( )
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe﹣═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2L恒容密闭容器中气态物质X、Y、Z的物质的量随时间变化的部分数据如表所示:
T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.80 | 1.00 | 0 |
1 | 0.70 | 0.80 | |
5 | 0.70 | ||
9 | 0.40 | ||
10 | 0.40 | 0.80 |
(1)写出该反应的化学方程式
(2)反应进行到10min,X的转化率为 , 0~5min内Y的平均反应速率为
(3)计算T℃时该反应的平衡常数K=
(4)T℃下向该密闭容器中通入一定量的X、Y、Z,反应到某时刻测得X、Y、Z的物质的量分别为1.00mol、0.50mol、1.60mol,则此时正逆反应速率大小:v正v逆(填“大于”、“等于”、“小于”)
(5)若在10min和t3、t5时刻分别改变该反应的某一反应条件,得到X、Z的物质的量及反应速率与时间的关系如图A、B所示: 
①10min时改变的反应条件是
②t3时刻改变的反应条件是t5时刻改变的反应条件是 , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐田法是把海水引入盐田,利用日光、风力蒸发浓缩海水,使其达到饱和,进一步将食盐结晶出来,这种方法在化学上称为
A.蒸发结晶B.冷却结晶C.重结晶D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,液氨的离子积常数K=c(NH4+)c(NH2﹣)=1.6×10﹣29 , 若用定义pH一样来规定pN=﹣lg c(NH4+),则在该温度下,下列叙述正确的是( )
A.纯净的液氨中,pN=7
B.纯净的液氨中,c(NH4+)c(NH2﹣)>1.0×10﹣14
C.1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D.1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液态氨中可电离出极少量的NH2-和NH4+。下列说法正确的是
A.NH3属于离子化合物B.常温下,液氨的电离平衡常数为10-14
C.液态氨与氨水的组成相同D.液氨中的微粒含相同的电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com