
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.
硫酸和硝酸是工业上具有重要用途的强酸.目前我国分别采用接触法和氨的催化氧化法制取硫酸和硝酸.下图表示的物质之间的转化关系中,虚线框内可分别表示硫酸、硝酸工业制法的生产流程,虚线框外是其他物质之间的相互转化(部分反应物、生成物没有列出).已知A是由两种元素组成的化合物,B是能使带有余烬的木条复燃的气体单质,E是硫酸或硝酸.J是日常生活中用途最多的、但在下列(1)、(2)两种情况中不同的金属单质.
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 312 |
| a3NA |
| 312 |
| a3NA |

查看答案和解析>>
科目:高中化学 来源:江苏省盐城中学2011-2012学年高二下学期期中考试化学试题 题型:022
Ⅰ.铂(Pt)单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示.

(1)由图可知,金属晶体铂的堆积方式为________,一个晶胞中含有________个铂原子,距离每个铂原子最近且等距离的铂原子有________个.
Ⅱ.铂元素的一种化合物:PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(2)PtCl2(NH3)2是________(填写选项字母);A平面四边形结构,B四面体结构
(3)请在下面空格内画出淡黄色固体分子的几何构型图:

(4)黄绿色固体物质是由________组成(填“极性分子”或“非极性分子”);
(5)两种固体在水中的溶解性差异,可以用________原理来解释;
(6)NH3中的N-H键是________(填写选项字母);
A.sp3-s σ键
B.sp2-s σ键
C.sp3-p σ键
D.sp3-s π键
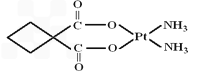
Ⅲ.碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,是第二代铂族抗癌药物.
碳铂的结构为:
(7)化学键种类很多,如:
A.极性共价键
B.非极性共价键
C.配位键
D.离子键
E.金属键
F.σ键
G.π键.碳铂中含有的作用力有________(填数字).
①ABCFG
②ABDF
③ACEG
④DE
(8)在碳铂分子中,C原子的杂化方式有________种.
查看答案和解析>>
科目:高中化学 来源:期中题 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com