
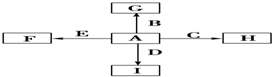
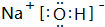 ,故答案为:
,故答案为: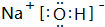 ;
;
| ||
| ||
| 1mol×2g/mol |
| 1g |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、原子核电荷数:Y>X>Z |
| B、原子半径大小的关系是:Y>Z>X |
| C、离子半径大小的关系是:Z(n+1)->Xn->Yn+ |
| D、氢化物的稳定性:Hn+1Z>HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、④⑤⑥ |
| C、①③⑤ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,14 gN2含有的分子数为0.5NA |
| B、50 mL1 mol/L的Na2SO4溶液中含Na+数为NA |
| C、标准状况下,22.4 L H2和O2的混合气体所含分子数为NA |
| D、24 g Mg与盐酸充分反应转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
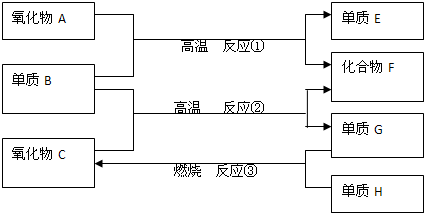
查看答案和解析>>
科目:高中化学 来源: 题型:
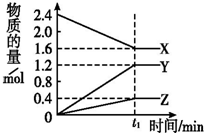 某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:
某温度下,在2L密闭容器中3种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1 min时到达平衡,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.反应在t1min时到达平衡,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸,使乙酸全部转化为乙酸乙酯 |
| B、混入Cl2中的HCl气体,可用饱和NaCl溶液除去 |
| C、除去Fe粉中的少量铝粉:加入NaOH溶液后过滤 |
| D、提取溶解在水中的少量溴:加入CCl4,振荡,静置,分层后,取出有机层再分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com