
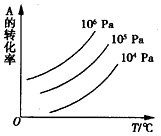
 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图3可以得出的正确结论是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图所示是A的转化率同压强、温度的关系,分析图3可以得出的正确结论是( )| A. | 正反应吸热,m+n>p+q | B. | 正反应吸热,m+n<p+q | ||
| C. | 正反应放热,m+n>p+q | D. | 正反应放热,m+n<p+q |
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | HCN易溶于水 | |
| B. | 氢氰酸溶液可以使pH试纸变红 | |
| C. | NaCN溶液显碱性 | |
| D. | 等物质的量的HCN与NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
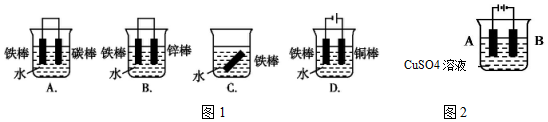
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | a=b | D. | 2b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量比为11:16 | B. | 密度比为11:16 | C. | 体积比为11:16 | D. | 分子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
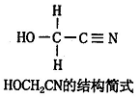
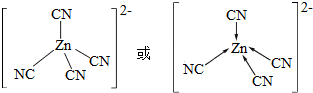 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何气体的体积都约为22.4L | |
| B. | 将1L 10 mol/L的浓盐酸与9L水混合时物质的量浓度为1 mol/L | |
| C. | 将22.4L氯化氢气体溶于水配成1L溶液时物质的量浓度为1 mol/L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都是1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com