
| A. | 常温常压下,7g乙烯(C2H4)与丙烯(C3H6)混合气体含有的氢原子数为NA | |
| B. | 标准状况下22.4L一氯甲烷和二氯甲烷的混合物中所含氯原子数介于NA至2NA之间 | |
| C. | lmol FeCl2与足量氯气反应时转移的电子数为2NA | |
| D. | 0.2 mol/L的Na2S溶液中,所含S2-数目小于 0.2NA |
分析 A.乙烯(C2H4)与丙烯(C3H6)最简式相同为CH2,计算7gCH2中含有的氢原子数;
B.二氯甲烷为液体不能使用标况下的气体摩尔体积计算混合物的物质的量;
C.二价铁离子被氯气氧化生成三价铁离子,氯气足量,依据二价铁离子的物质的量计算转移电子数;
D.溶液体积未知.
解答 解:A.乙烯(C2H4)与丙烯(C3H6)最简式相同为CH2,计算7gCH2中含有的氢原子数=$\frac{7g}{14g/mol}$×2=1mol,故A正确;
B.二氯甲烷标准状况下为液态,无法计算混合气体中含有的氯原子的范围,故B错误;
C.lmol FeCl2与足量氯气反应生成1mol氯化铁,转移的电子数为NA,故C错误;
D.溶液体积未知,无法确定硫离子数目,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为 6.0kJ•mol-1,冰中氢键键能为 20 kJ•mol-1,若熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 在一定条件下,某可逆反应的△H=+100 kJ•mol-1,则该反应正反应活化能比逆反应活化能大100 kJ•mol-1 | |
| C. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则 1molCH4 发生反应CH4(g)+2O2(g)═CO2 (g)+2H2O (g) 放出的热量小于 890.3 kJ•mol-1 | |
| D. | 500℃、30 MPa 下,将 0.5 mol N2 和 1.5 mol H2 置于密闭容器中充分反应生成NH3 (g),放出量热 19.3 kJ,其热化学方程式可表示为: N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ④⑤⑥ | C. | ①②③ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.8mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(D)=0.5 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,v(逆)增大 | B. | 压强不变时,反应达到平衡状态 | ||
| C. | 升高温度,v(逆)、v(正)都增大 | D. | 平衡后加入X,X转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
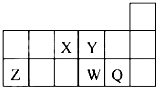
| A. | 元素X与元素Z的正化合价之和的数值等于8 | |
| B. | 原子半径的大小顺序为rX>rY>rZ>rW>rQ | |
| C. | Y和Z形成了共价化合物 | |
| D. | 元素W周期表中的位置是第三周期,第VI主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体可用将FeCl3饱和溶液滴入沸水的方法来制备 | |
| B. | Fe(OH)3胶体电泳时,可以观察到阳极颜色加深 | |
| C. | 向 Fe(OH)3胶体中逐滴滴加稀盐酸,现象是先产生红褐色沉淀后沉淀溶解 | |
| D. | 不断搅拌Fe(OH)3胶体,溶液会变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨通常是指pH在7以下的降水 | |
| B. | 氮氧化物是造成光化学烟雾的主要原因 | |
| C. | 大气污染主要指CO、SO2、氮氧化物以及粉尘等 | |
| D. | N与S的氧化物直接危害人的身体健康,引发呼吸道疾病 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com