
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④⑤ | D. | ③④⑤ |
分析 ①根据O2和O3均由氧原子构成来计算;
②只有浓硫酸才能与铜在加热条件下发生反应,稀硫酸与铜不反应;
③Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;
④标况下,C6H6的状态不是气体,不能使用标况下的气体摩尔体积计算己烷的物质的量;
⑤因为氢氧化铝为弱碱,所以铝离子要发生水解.
解答 解:①O2和O3均由氧原子构成,故3.2g混合气体中氧原子的物质的量n=$\frac{m}{M}$=$\frac{3.2g}{16g/mol}$=0.2mol,个数为0.2NA个,故①正确;
②浓硫酸随反应进行浓度变稀后不能和铜在继续反应,硫酸不能全部反应;含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA;故②错误;
③Na2S和Na2O2摩尔质量相同,过氧化钠是有钠离子和过氧根离子构成;7.8g Na2S和Na2O2的混合物物质的量为0.1mol,含有的阴离子数0.1NA;故③错误;
④标准状况下,C6H6不是气体,不能使用标况下的气体摩尔体积计算22.4LC6H6的物质的量,故④错误;
⑤因为氢氧化铝为弱碱,所以铝离子要发生水解,所以1L 0.1mol/L的 Al2(SO4)3溶液中,Al3+的数目小于0.2NA,故⑤错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题题量较大,涉及的知识点较多,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


科目:高中化学 来源: 题型:选择题
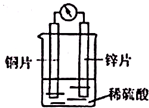
| A. | 溶液中H+向锌极移动 | |
| B. | 铜片是正极,发生氧化反应,有气泡产生 | |
| C. | 锌片上的电极反应式:Zn-2e-═Zn2+ | |
| D. | 电子由铜片经导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不同金属的冶炼方法选择的原则主要是依据金属离子得电子的能力 | |
| B. | 金属的冶炼都是置换反应 | |
| C. | 应该大力开发金属矿物资源以满足人类生产生活的需要 | |
| D. | 工业上从海水中提取镁:海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-16Q kJ•mol-1 | |
| B. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-8Q kJ•mol-1 | |
| C. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(l)△H=-Q kJ•mol-1 | |
| D. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-Q kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
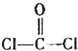 的空间结构为平面三角形.
的空间结构为平面三角形.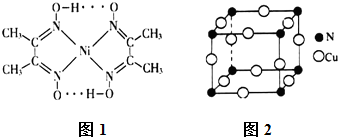
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸中不含羟基 | |
| B. | 乳酸不能发生消去反应 | |
| C. | 乳酸与足量钠反应时物质的量之比为1:1 | |
| D. | 乳酸与足量NaOH溶液反应时物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
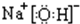
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com