
分析 高温下加热84gA分解产生0.5mol的离子化合物B和44.8L的气体C(标准状况下),C能使湿润的红色石蕊试纸变蓝,则C为NH3,由元素守恒可知A含有N、H元素,A含有三种短周期元素,其中一种元素的原子最外层电子数等于最内层电子数,最外层电子数为2,处于ⅡA族,A、B发生水解反应均产生同一种白色沉淀和气体C,离子化合物B化学式符合M3N2,分解生成氨气为$\frac{44.8L}{22.4L/mol}$=2mol,0.5mol B的质量为84g-2mol×17g/mol=50g,B的相对分子质量为$\frac{50}{0.5}$=100,则M的相对原子质量为$\frac{100-14×2}{3}$=24,故M为Mg,B为Mg3N2,A、B水解均得到氢氧化镁与氨气,可推知A为Mg(NH2)2,据此解答.
解答 解:高温下加热84gA分解产生0.5mol的离子化合物B和44.8L的气体C(标准状况下),C能使湿润的红色石蕊试纸变蓝,则C为NH3,由元素守恒可知A含有N、H元素,A含有三种短周期元素,其中一种元素的原子最外层电子数等于最内层电子数,最外层电子数为2,处于ⅡA族,A、B发生水解反应均产生同一种白色沉淀和气体C,离子化合物B化学式符合M3N2,分解生成氨气为$\frac{44.8L}{22.4L/mol}$=2mol,0.5mol B的质量为84g-2mol×17g/mol=50g,B的相对分子质量为$\frac{50}{0.5}$=100,则M的相对原子质量为$\frac{100-14×2}{3}$=24,故M为Mg,B为Mg3N2,A、B水解均得到氢氧化镁与氨气,可推知A为Mg(NH2)2.
(1)A受热分解的化学方程式:3Mg(NH2)2$\frac{\underline{\;高温\;}}{\;}$4NH3↑+Mg3N2,因氨气极易溶于水,不能用排饱和氯化铵溶液的方法收集氨气,
故答案为:3Mg(NH2)2$\frac{\underline{\;高温\;}}{\;}$4NH3↑+Mg3N2;否;因氨气极易溶于水;
(2)在微电子工业中,氨气的水溶液可做刻蚀剂H2O2的清除剂,所发生的产物不污染环境,反应生成氮气与水,反应方程式为:2NH3•H2O+3H2O2═N2↑+8H2O 或2NH3+3H2O2═N2↑+6H2O,
故答案为:2NH3•H2O+3H2O2═N2↑+8H2O 或2NH3+3H2O2═N2↑+6H2O;
(3)NH3连续氧化可以产生2种常见气体,它们是制备硝酸的中间产物,分别为NO、NO2,将这两种氧化物按物质的量1:1溶于冰水可以得到一种弱酸D为HNO2,其酸性比醋酸略强,则其酸性比较碳酸强,不能由二氧化碳与NaNO2溶液反应得到,由于HNO2氧化性比I2强,NaNO2溶液溶液通入二氧化硫,会将二氧化硫氧化,不能得到HNO2,可以用盐酸、硫酸与NaNO2反应得到HNO2,
故选ac,
故答案为:ac;
(4)A为Mg(NH2)2.其中氮元素化合价-3价,具有还原性,氯气具有氧化性,二者中能发生氧化还原反应生成N2、MgCl2和HCl,
故答案为:能; Cl2是强氧化剂,Mg(NH2)2中氮显-3价,具有还原性,二者可以发生氧化还原反应(产物是N2、MgCl2和HCl).
点评 本题考查无机物推断,物质的性质、反应现象、原子结构特点为推断突破口,侧重考查学生分析推理能力,难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 12C和14C | B. | O2与O3 | ||
| C. | 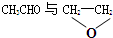 | D. | CH3CH2CH2CH3与CH3CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验中要配制490mL 0.2mol/L KCl溶液,需要托盘天平称量7.3g KCl固体 | |
| B. | 室温下,浓度均为0.1mol/L Na2S2O3和H2SO4溶液,分别取6mL与10mL混合、10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 | |
| C. | 往盛有少量淀粉溶液的试管中加入一定量稀硫酸,加热3~4分钟后,再加入NaOH溶液至碱性,最后加入银氨溶液并水浴加热,有银镜产生 | |
| D. | 在中和热的测定实验中,将KOH溶液迅速倒入装有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH | B. | CH3OCOOCH3 | C. | CH3CH2C(CH3)3 | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的水中含有0.5NA个水分子 | |
| B. | 含有1molHCl的盐酸中离子总数为NA个 | |
| C. | 1molO2和H2的混合气体中含有NA个分子 | |
| D. | 1mol大米中含有NA个大米粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
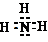 ;C气体的化学式是SO2.
;C气体的化学式是SO2.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
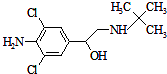 克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )
克伦特罗是“瘦肉精”的一种,其结构如图所示,关于该有机物的说法正确的是( )| A. | 该有机物的分子式为C12H18Cl2N2O | |
| B. | 1mol该有机物中含有3mol碳碳双键 | |
| C. | 该有机物中至少有15个原子在同一平面内 | |
| D. | 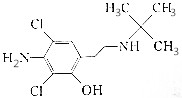 和该有机物互为同分异构体 和该有机物互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com