
 B��
B��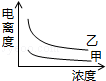 C��
C��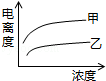 D��
D��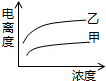
���� ��1���÷�Ӧ��SԪ�ػ��ϼ���+4�۱�Ϊ+6�ۡ�CrԪ�ػ��ϼ���+6�۱�Ϊ+3�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ��������ƽ����ʽ�ã��õ��ӻ��ϼ۽��͵�Ԫ�ر���ԭ��
��2��������SO2ͨ��Na2S��Һ�����߷���������ԭ��Ӧ����S��ͬʱ�������������ƣ�
��3��n��NaOH��=0.3mol/L��1L=0.3mol��n��SO2��=$\frac{4.48L}{22.4L/mol}$=0.2mol��������Na2SO3��NaHSO3�����ʵ����ֱ���xmol��ymol������Na��Sԭ���غ��x+y=0.22x+y=0.3��ã�x=0.1mol��y=0.1mol��������Һ�е������ǵ����ʵ�����Na2SO3��NaHSO3����Һ�д��ڵ���غ㡢�����غ�������غ㣻
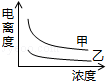
��4�������ᣨ�ס�Ka=1.8��10-5���ʹ����ᣨ�ҡ�Ka=2.95��10-8����֪���������KaС��������������������Ũ��ʱ����ǿ�ĵ���ȴ������Ũ��Խ��������ԽС���Դ������
��� �⣺��1���÷�Ӧ��SԪ�ػ��ϼ���+4�۱�Ϊ+6�ۡ�CrԪ�ػ��ϼ���+6�۱�Ϊ+3�ۣ�ת�Ƶ�����Ϊ6������ת�Ƶ��������ƽ����ʽ3SO2+K2Cr2O7+11H2O+H2SO4=2KCr��SO4��2.12H2O���õ��ӻ��ϼ۽��͵�Ԫ�ر���ԭ����CrԪ�ر���ԭ��
�ʴ�Ϊ��3SO2+K2Cr2O7+11H2O+H2SO4=2KCr��SO4��2.12H2O��Cr��
��2��������SO2ͨ��Na2S��Һ�����߷���������ԭ��Ӧ����S��ͬʱ�������������ƣ����ӷ���ʽΪ2H2O+2S2-+5SO2=4HSO3-+3S����
�ʴ�Ϊ��2H2O+2S2-+5SO2=4HSO3-+3S����
��3��n��NaOH��=0.3mol/L��1L=0.3mol��n��SO2��=$\frac{4.48L}{22.4L/mol}$=0.2mol��������Na2SO3��NaHSO3�����ʵ����ֱ���xmol��ymol������Na��Sԭ���غ��x+y=0.22x+y=0.3��ã�x=0.1mol��y=0.1mol��������Һ�е������ǵ����ʵ�����Na2SO3��NaHSO3����Һ�д��ڵ���غ㡢�����غ�������غ㣬���ݵ���غ��c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-�������������غ��2c��Na+��=3c��HSO3-��+3c��SO32-��+3c��H2SO3����]����[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L�����������غ��c��HSO3-��+3c��H2SO3��+2c��H+��=c��SO32-��+2c��OH-����
�ʴ�Ϊ��2c��Na+��=3c��HSO3-��+3c��SO32-��+3c��H2SO3����[SO32-]+[HSO3-]+[H2SO3]=0.2mol/L��c��HSO3-��+3c��H2SO3��+2c��H+��=c��SO32-��+2c��OH-����
��4�������ᣨ�ס�Ka=1.8��10-5���ʹ����ᣨ�ҡ�Ka=2.95��10-8����֪���������KaС������������������
��ͼ��֪��������ΪŨ�ȣ�������Ϊ����ȣ����Ũ��ʱ����ǿ�ĵ���ȴ����������Ϸ������ų�BD��
�����Ũ��Խ��������ԽС�������ס��Ҿ���Ũ�ȵ�������½������ų�C����Ȼֻ��A���ϣ�
��ѡA��
���� ���⿼�麬�����ʵ��ۺ�Ӧ�ã��漰������ԭ��Ӧ�����ֽⷴӦ������ˮ�⡢����Ũ�ȴ�С�Ƚϡ�������ʵĵ����֪ʶ�㣬���ؿ���������ۣ���Щ֪ʶ�㶼�Ǹ�Ƶ���㣬��ȷ���ʵ������ǽⱾ��ؼ�����Ŀ�Ѷ��еȣ�


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д� ѧҵ����һ��һ��ϵ�д�
ѧҵ����һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C3H8O | B�� | C4H10O | C�� | C4H8Cl2 | D�� | C5H11Cl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3��3-��������  | B�� | l-��ϩ��CH2=CH-CH2-CH3 | ||
| C�� | ����ױ���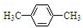 | D�� | ���״���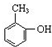 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 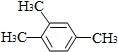 1��2��4-���ױ� | B�� | 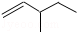 3-��-1-��ϩ | C�� | 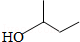 2-��-1-���� | D�� |  1��3-������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʳƷ���Ӽ���ʳ������彡�����к� | |
| B�� | ʯ�ͷ���ú����������ˮɹ�Ρ���ȥ���۵ȹ��̶��ǻ�ѧ�仯 | |
| C�� | �ƺ��뺣��ɳ���γ�����±ˮ�㶹�����������˽���۳������� | |
| D�� | ����������ľ�����ά�����ڹ���ͨ�ŵĹ��ά�����������ǽ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
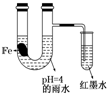 ��ͼװ���У�������ʵ������ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ����ڵ�Һ��������Ը���U���е�Һ�森�����йؽ��Ͳ��������ǣ�������
��ͼװ���У�������ʵ������ʼʱ����С�Թ��еĵ����ڵ�Һ���½���һ��ʱ����ڵ�Һ��������Ը���U���е�Һ�森�����йؽ��Ͳ��������ǣ�������| A�� | ����Ƭ��������̼����ǿ���Ŀ���ʴ�� | |
| B�� | ��ˮ���Խ�ǿ������Ƭ��ʼ�������ⸯʴ | |
| C�� | ������īˮҺ�����ʱ��������Ӧʽ��O2+2H2O+4e-�T4OH- | |
| D�� | ���ŷ�Ӧ�Ľ��У�U������ˮ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
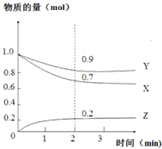 ij�¶�ʱ����2L�����ܱ������У�X��Y��Z������̬���ʵı仯������ͼ��ʾ��������仯��һЩ˵����ȷ���ǣ�������
ij�¶�ʱ����2L�����ܱ������У�X��Y��Z������̬���ʵı仯������ͼ��ʾ��������仯��һЩ˵����ȷ���ǣ�������| A�� | �÷�Ӧ�Ļ�ѧ����ʽ��3X+Y?2Z | |
| B�� | ��Ӧ��ʼ��2min��Z��ƽ����Ӧ���ʣ�0.1mol/��L•min�� | |
| C�� | ����3min��Z�ӷ�Ӧ��ϵ�з��룬ƽ�ⲻ�ƶ� | |
| D�� | ��X��ʾ�û�ѧ��Ӧ���ʱ���Y��ʾ��Ҫ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com