
分析 (1)将将平衡混合气体中氨气分离,恰好能与250mL2mol•L-1的稀硫酸溶液反应生成正盐,氨气和硫酸反应方程式为2NH3+H2SO4=(NH4)2SO4,n(H2SO4)=2mol/L×0.25L=0.5mol,根据方程式知n(NH3)=2n(H2SO4),v(NH3)=$\frac{\frac{△n}{V}}{△t}$;
(2)可逆反应达到平衡后,同一物质的正逆反应速率相等;
(3)根据生成氨气物质的量、初始氮气和氢气的物质的量关系、平衡时氮气和氢气的浓度之比计算原容器中氮气的物质的量.
解答 解:(1)将将平衡混合气体中氨气分离,恰好能与250mL2mol•L-1的稀硫酸溶液反应生成正盐,氨气和硫酸反应方程式为2NH3+H2SO4=(NH4)2SO4,n(H2SO4)=2mol/L×0.25L=0.5mol,根据方程式知n(NH3)=2n(H2SO4)=0.5mol×2=1mol,v(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L.min),
故答案为:1mol;0.1mol/(L.min);
(2)可逆反应达到平衡后,同一物质的正逆反应速率相等,所以反应达到平衡后,单位时间内生成氨气和分解氨气的物质的量相等,所以氨气的物质的量不变,
故答案为:单位时间内生成氨气和分解氨气的物质的量相等;
(3)设原来容器中氮气和氢气的物质的量都是amol,
N2(g)+3H2(g)?2NH3(g),
开始(mol) a a 0
反应(mol)0.5 1.5 1
平衡(mol)a-0.5 a-1.5 1
平衡时c(N2):c(H2)=3:1;因为是同一容器,所以容器体积相同,则c(N2):c(H2)=n(N2):n(H2)=(a-0.5):(a-1.5)=3:1,a=2,
所以原容器中氮气的物质的量是2mol,
答:原容器中氮气的物质的量是2mol.
点评 本题考查化学平衡有关计算,侧重考查学生获取信息、分析、计算能力,明确各个物理量的关系是解本题关键,注意灵活运用“三段式”法解答有关化学平衡计算,题目难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质
C.胶体区别于其它分散系的本质特性是具有丁达尔现象
D.利用半透膜可除去淀粉溶液中的少量NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
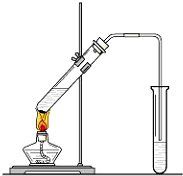 在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:
在实验室我们可以用如图所示的装置来制取乙酸乙酯.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
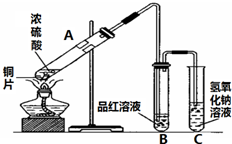 图是进行铜与浓硫酸反应并进行产物检验的装置.
图是进行铜与浓硫酸反应并进行产物检验的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
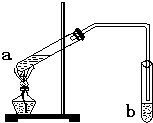 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们可以用如图所示的装置来制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
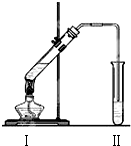 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.| 实验 编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 饱和Na2CO3溶液 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL3mol•L-1硫酸 | 饱和Na2CO3溶液 | 1.2 |
| D | 3mL乙醇、2mL乙酸、6mL6mol•L-1盐酸 | 饱和Na2CO3溶液 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
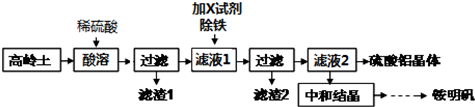
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com