
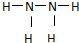 ,过氧化氢的电子式
,过氧化氢的电子式 .
.分析 (1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,过氧化氢分子式H2O2,每个氧原子形成两个共价键,依据结构写出物质的结构式;
(2)依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(3)依据热化学方程式和盖斯定律计算得到热化学方程式,得到反应的焓变;
(4)肼燃烧生成氮气和水;
(5)根据盖斯定律来计算焓变并根据热化学方程式的书写方法来书写.
解答 解:(1)肼分子式为NH2-NH2,每个氮原子形成三个化学键,结构式为: ;过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为:
;过氧化氢分子式H2O2,每个氧原子形成两个共价键,分子结构为: ;
;
故答案为: ;
; ;
;
(2)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量,32g肼燃烧放热640kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol;
(3)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1 …①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-…②;
依据盖斯定律,①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-816kJ/mol
则16g液态肼与足量液态过氧化氢反应生成氮气和液态水放热时408KJ;
故答案为:408;
(4)肼燃烧生成氮气和水,除释放大量热和快速产生大量气体外,生成的物质无污染;
故答案为:生成物无污染;
(5)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
N2 (g)+2O2(g)═2NO2(g);△H1=67.7kJ/mol ①
N2H4(g)+O2(g)═N2(g)+2H2O(g);△H2=一534kJ/mol ②
结结合盖斯定律②×2-①得到肼与NO2反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);
故答案为:C.
点评 本题考查了化学反应能量变化的计算应用,物质结构分析判断,盖斯定律的计算,热化学方程式书写方法,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙二醇 | C. | 乙醇 | D. | 乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| O | |
| S | |
| Se | Br |
| A. | 硒位于元素周期表第四周期第IVA族 | |
| B. | 硒的非金属性比S弱 | |
| C. | H2Se比HBr稳定 | |
| D. | 最高价氧化物的化学式为SeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )
常温下,用0.1mol•L-1的NaOH溶液滴定10.0mL0.1mol•L-1的HA溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | HA是弱酸 | B. | ②处:c(H+)>c(OH-) | ||
| C. | ①处:c(Na+)=c(A-)+c(HA) | D. | ②处:c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①②中Mg作负极,③④中Fe作负极 | |
| B. | ②中Mg作正极,电极反应式为:2H2O+2e-═2OH-+H2↑ | |
| C. | ③中Fe作负极,电极反应式为Fe-2e-═Fe2+ | |
| D. | ④中Cu作正极,电极反应式为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | G4H10的一种同分异构体只能生成一种一氯代物 | |
| B. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子不可能都在一条直线上 | |
| C. | 某物质的名称为:2-甲基-3-乙基丁烷 | |
| D. | 制取1,2-二溴乙烷的最合理的方法是乙烯与HBr进行加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com