
【题目】CCl3CHO是一种药物合成的中间体,可通过CH3CH2OH + 4Cl2 → CCl3CHO+5HCl进行制备。制备时可能发生的副反应为C2H5OH + HCl→C2H5Cl + H2O、CCl3CHO+HClO—CCl3COOH+HCl。合成该有机物的实验装置示意图(加热装 置未画出)和有关数据如下:


(1)A中恒压漏斗的作用是______;A装置中发生反应的化学方程式为_____。
(2)装置B的作用是____;装置F在吸收气体时,为什么可以防止液体发生倒吸现象______。
(3)装置E中的温度计要控制在70℃,三口烧瓶采用的最佳加热方式是______。如果要在球形冷凝管中注入冷水增加冷凝效果,冷水应该从_____(填“a”或“b”)口通入。实验使用球形冷凝管而不使用直形冷凝管的目的是________。
(4)实验中装置C中的试剂是饱和食盐水,装置中D的试剂是浓H2SO4。如果不使用D装置,产品中会存在较多的杂质_______(填化学式)。除去这些杂质最合适实验方法是______。
(5)利用碘量法可测定产品的纯度,反应原理如下:
CCl3CHO+NaOH→CHC13+HCOONa
HCOONa+I2=HI+NaI+CO2
I2+2Na2S2O3=2NaI+Na2S4O8
称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,调节溶液 为合适的pH后,加入30.00 mL 0.100 mol L-1的碘标准液,用0 100 mol L-1的 Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL,则该次实验所得产品纯度为_________。
【答案】保持漏斗和反应容器内的气压相等 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 安全瓶(或防止装置C中液体倒吸入装置A中) 漏斗口径较大,被吸住的液体会迅速回落烧杯中 水浴 b 增大蒸气与外界接触面积,提高冷凝回流效果 C2H5Cl、CCl3COOH 蒸馏 59%
【解析】
A装置利用高锰酸钾与浓盐酸制备氯气,C装置用饱和食盐水除去HCl,D装置盛放浓硫酸干燥氯气,E中反应制备CCl3CHO。F装置盛放氢氧化钠溶液,吸收尾气中氯气、HCl防止污染空气。
(1)A中的恒压漏斗使得漏斗中的压强和圆底烧瓶中的压强相同,从而浓盐酸能够顺利流下。高锰酸钾与浓盐酸反应生成氯气,方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)装置B中的导管很短,而且B中没有试剂,所以是作安全瓶,防止C装置处理HCl气体时发生倒吸。装置F中倒扣的漏斗,与液体接触的部分横截面积很大,被吸住的液体会迅速回落烧杯中,不会发生倒吸。答案为安全瓶 漏斗口径较大,被吸住的液体会迅速回落烧杯中;
(3)温度要控制在70℃,未超过水的沸点100℃,可以选择水浴加热,即最佳的加热方式为水浴加热。冷凝过程中,冷凝管中应该充满水,所以冷水应该从b口进。球形冷凝管与蒸气接触的面积大,冷凝回流效果更好。 答案为:水浴 b 增大蒸气与外界接触面积,提高冷凝回流效果;
(4)如果没有浓硫酸干燥,则E中会有水参加反应,水与氯气反应生成HCl和HClO,副反应就会发生,生成的产物有C2H5Cl、CCl3COOH。从图表所给的信息来看,杂质均溶于乙醇,得到一混合液体,且沸点相差较大,使用蒸馏,可以分离除去;
(5)加入的碘单质被硫代硫酸钠和CCl3CHO消耗,加入的碘单质的物质的量为0.03L ×0.100 mol L-1=0.003mol,消耗的Na2S2O3的物质的量为0.02L ×0.100 mol L-1=0.002mol。有关系式为
I2 ~CCl3CHO I2 ~ 2Na2S2O3
0.001mol 0.002mol
CCl3CHO消耗碘单质的物质的量为0.003-0.001mol=0.002mol,则10mL的溶液中含有CCl3CHO的物质的量为0.002mol。100mL溶液中含有CCl3CHO为0.02mol,质量为0.02mol×147.5g=2.95g,则纯度![]() 。
。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】铁、钴、镍及其化合物有许多用途。回答下列问题:
(1)基态铁原子核外共有____________种不同空间运动状态的电子,铁、钴、镍基态原子核外未成对电子数最少的价层电子的电子排布图(轨道表达式)为_________________。
(2)酞菁钴分子的结构简式如图甲所示,分子中与钴原子通过配位键结合的氮原子的编号是______(填“1”“2”“3”或“4”),分子中三种非金属原子的电负性由大到小的顺序为____________(用相应的元素符号表示),分子中碳原子的杂化轨道类型为____________。

(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,该晶体固态下不导电,熔融状态、水溶液均能导电,该晶体属于__________(填晶体类型)。配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=__________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO__________FeO(填“>”“<”或“=”),原因是______________________________。
(5)Ni、O、Cr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图乙所示,晶胞边长为apm,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_______g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为_________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合作学习小组讨论辨析下列说法,其中说法正确的数目为
①离子反应可能是复分解反应,但一定不是氧化还原反应②电解质在水中一定能导电,非电解质在水中一定不导电③CO2的水溶液可以导电,故 CO2是电解质④同温同压下,等质量的二氧化硫气体和二氧化碳气体密度比为 16:11,体积比为 11:16⑤某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
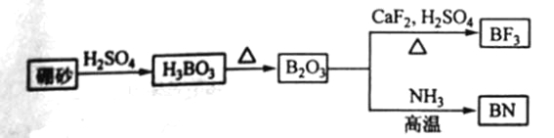
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质投入溶液中,溶液质量减轻的是( )
A.CaCO3投入到HCl溶液中
B.Na2CO3投入稀硫酸中
C.Fe粉投入CuSO4溶液中
D.Fe粉投入稀HCl溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出一种或两种作反应物,按下列要求的反应类型各写一个化学方程式。
(1)化合反应_______;
(2)分解反应________;
(3)置换反应________;
(4)复分解反应_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴滴涕(DDT)是20世纪60年代以前广为应用的一种杀虫剂,其结构简式为

DDT因其稳定性、脂溶性、药效普适性等特点而大量使用,最终造成环境污染。下列关于DDT的说法,不正确的是( )
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) △H=-53.7kJ/mol
H2O(g)+CH3OH(g) △H=-53.7kJ/mol
(1) 308K时,向2L密闭容器中通入0.04 mol CO2和0.08 mol H2,测得其压强(p)随时间(t)变化如图1中曲线I所示。


①反应开始至达平衡时,υ(H2)=________;该温度下反应的平衡常数为______mol-2·L2。
②若只改变某一条件,其他条件相同时,曲线变化为II,则改变的条件是____。
(2)还可以通过以下途径实现CO2向CH3OH的转化:
反应I:CO2(g)+H2(g)![]() H2O(g)+CO(g) △H<0
H2O(g)+CO(g) △H<0
反应Ⅱ:2H2(g)+CO(g)![]() CH3OH(g) △H<0
CH3OH(g) △H<0
反应I和反应Ⅱ的平衡常数K随温度T的变化如图2所示。
①根据图中数据分析可知,T1____T2(填“>”、“<”或“=”);T2时CO2转化为CH3OH的平衡常数K=_______;
②目前,许多国家采用CO2代替CO(以煤和天然气为原料)生产CH3OH,其优点是_________。
(3)用电解法可将CO2转化为多种燃料,原理如图3。铜电极上产生HCOOH的电极反应式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是

A. ①中溶液红色褪去的原因是:CH3COOC2H5 + NaOH =CH3COONa + C2H5OH
B. ②中溶液变红的原因是:CH3COO- + H2O ![]() CH3COOH + H+
CH3COOH + H+
C. 由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D. ④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com