
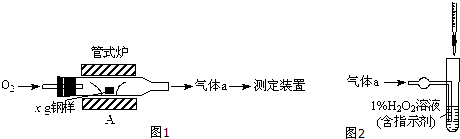
| ||
| ||
| yzg |
| xg |
| yz |
| x |
| yz |
| x |
| ①+③ |
| 2 |


科目:高中化学 来源: 题型:
| A、C(H+)=10-3mol/L |
| B、C(OH-)=10-9mol/L |
| C、pH=4 |
| D、溶液中由水电离的C(H+)=10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:

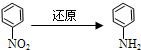 )
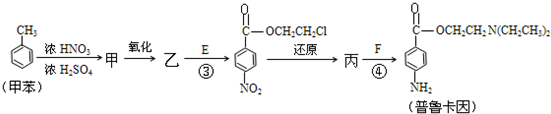
)
查看答案和解析>>
科目:高中化学 来源: 题型:
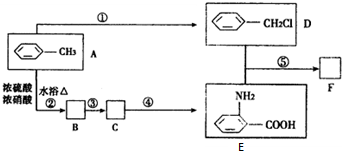
| 一定条件 |

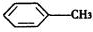 与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.
与浓硫酸、浓硝酸混合在不同温度下会得到不同产物.查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | A | B | C |
| 结构简式 |  | 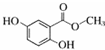 | 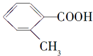 |
| 化合物 | D | E | F |
| 结构简式 | 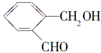 | 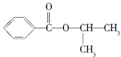 | 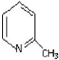 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | ( | ( | |||
| ( | ( | ( | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
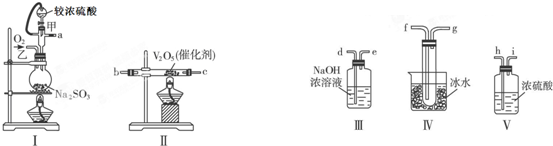
查看答案和解析>>
科目:高中化学 来源: 题型:
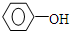 ;④CH3COOC2H5;⑤CH3COOH五物质中:
;④CH3COOC2H5;⑤CH3COOH五物质中:查看答案和解析>>
科目:高中化学 来源: 题型:
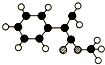 A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).
A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图所示(如图中球与球之间连线代表化学键单键或双键).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com