
工业上曾经通过反应“3Fe+4NaOH Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
科目:高中化学 来源: 题型:解答题
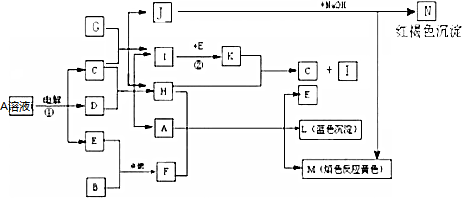
 ,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目
,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目 .
.查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
稀硫酸和系硝酸的混合液,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10ml此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3倍还原成NO)
A.0.672L B.0.448L C.0.896L D.0.224L
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:填空题
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ==2xCO2+N2
当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入2 mol CO和6 mol H2
(2)一定条件下,CO与H2可合成甲烷,反应方程式为CO(g)+3H2(g) CH4 (g)+H2O(g)
CH4 (g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 。
②已知H2(g)、CO(g)、和CH4 (g)的燃烧△H分别等于aKJ/mol和cKJ/mol,写出CO与H2反应生成CH4和CO2的热化学方程式: 。
(3)甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: 。
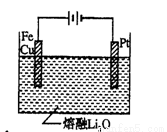
(4)CuFe2O4可用电化学方法得到,其原理如图所示,则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象 | 结论 | |
A | 用玻璃棒蘸取某溶液做焰色反应,可看到黄色火焰 | 溶液中一定有Na+ |
B | 向淀粉溶液中加入稀H2SO4,加热几分钟, 冷却后再加入新制Cu(0H)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
C | 向无水乙醇中加入浓H2SO4,加热至170℃ 产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
D | 向某溶液中加稀盐酸无现象,再加入BaCl2溶液,生成白色沉淀 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用的说法正确的是
A.晶体硅具有半导体性质,可用于生成光导纤维
B.用Na2O2漂白过的织物、麦秆日久又渐渐变成黄色
C.K2FeO4具有强氧化性,可用于自来水的杀菌消毒、
D.浓硫酸具有较强酸性,常用作淀粉水解的催化剂
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.甲酸甲酯的结构简式:CH2O
B.Na+的结构示意图: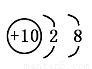
C.质子数为53、中子数为78的碘原子:13153I
D.CO2的电子式: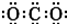
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体[A12(SO4)3•18H2O].查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com