

| A. | 锌是正极,铜是负极,电流的方向是从锌到铜 | |
| B. | 锌片质量减少,铜片质量增加 | |
| C. | 正极和负极上发生的都是氧化还原反应 | |
| D. | 原电池中的能量变化是:化学能转化为电能 |
分析 铜-锌-稀硫酸构成的原电池中,锌是负极,负极上锌失电子发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极,结合原电池定义分析解答.
解答 解:A、Zn、Cu、硫酸构成的原电池中,活泼金属锌做负极,电流方向是从Cu片通过导线流向Zn片,故A错误;
B、Zn、Cu、硫酸构成的原电池中,活泼金属锌做负极,铜为正极,正极上氢离子得电子发生还原反应,Cu电极质量不变,故B错误;
C、Zn、Cu、硫酸构成的原电池中,锌是负极,负极上锌失电子发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,故C错误;
D、原电池装置是将化学能转化为电能的装置,故D正确;
故选D.
点评 本题考查学生原电池的工作原理,明确正负两极的反应原理是解题的关键,难度不大.


科目:高中化学 来源: 题型:实验题
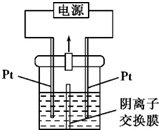 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
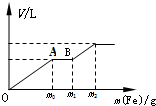 往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示
往一个盛有100mL的硝酸(浓度为1.0mol/L)和硫酸(浓度为2.0mol/L)的混和稀溶液中逐渐加入铁粉至反应停止,生成的气体与所加入铁粉的质量如下所示查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅可用作半导体材料 | |
| B. | 二氧化硅可用于制造光导纤维 | |
| C. | Fe2O3 俗称铁红,常用作红色油漆和涂料 | |
| D. | 煤是一种清洁能源,直接燃烧不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑤ | C. | ④⑤⑧ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com