
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述错误的是
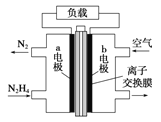
A.b极发生还原反应
B.a极的反应式为N2H4 - 4e-=N2↑+4H+
C.放电时,电流从b极经过负载流向a极
D.其中的离子交换膜需选用阴离子交换膜
科目:高中化学 来源: 题型:
【题目】在室温下,下列四种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(H+) B.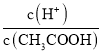 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.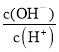 E.
E.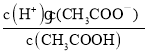
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大。下列古代文献中有关化学现象记载合理的是( )
A.李白的诗句“日照香炉生紫烟,遥看瀑布挂前川”,只涉及化学变化
B.苏轼的诗句“梨花淡白柳深青柳絮飞时花满城”中,柳絮的主要成分是蛋白质
C.东晋![]() 抱朴子
抱朴子![]() 中的“丹砂
中的“丹砂![]() 烧之成水银,积变又成丹砂”,描述的是可逆反应
烧之成水银,积变又成丹砂”,描述的是可逆反应
D.南北朝![]() 本草经集注
本草经集注![]() 中的“以火烧之,紫青烟起,云是真硝石也”,描述的是用焰色反应检验硝酸钾
中的“以火烧之,紫青烟起,云是真硝石也”,描述的是用焰色反应检验硝酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂、杀草丹等农药。可通过H2S与CO2在高温下反应制得COS:H2S(g)+CO2(g) ![]() COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
COS(g) +H2O(g) △H > 0。在2 L容器中充入一定量的H2S和CO2发生上述反应,数据如下:
实验 | 温度/℃ | 起始时 | 平衡时 | 平衡 常数 | |||
n(CO2)/mol | n(H2S)/mol | n(COS)/mol | n(H2O)/mol | n(COS)/mol | |||
1 | T1 | 0.200 | 0.200 | 0 | 0 | 0.0200 | K1 |
2 | T2 | 0.200 | 0.200 | 0 | 0 | n2 | K2 =1/36 |
3 | T2 | 0.400 | 0.400 | 0 | 0 | n3 | K3 |
下列判断不正确的是
A. K1=1/81
B. K2 = K3且n3= 2n2
C. 初始反应速率:实验3 gt; 实验2 > 实验1
D. 实验2中平衡时的c(COS)约为0.0286 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下纯水中的c(H+)=2×10-7mol/L,对此下列说法正确的是( )
A.若向水中加入少量盐酸,则水的电离度减小
B.该温度低于25℃
C.此温度下水的离子积为常温下的两倍
D.据此无法求算水中c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用离子方程式表示泡沫灭火器的灭火原理:______________
(2)25℃时,Ksp[Fe(OH)3]=2.79×10﹣39,该温度下反应Fe(OH)3+ 3H+ ![]() Fe3++ 3H2O的平衡常数K=_______
Fe3++ 3H2O的平衡常数K=_______
(3)在加热条件下 CeCl3 易发生水解,无水 CeCl3 可用加热 CeCl3·6H2O 和 NH4Cl 固体混合物的方法来制备。其中NH4Cl 的作用是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知![]() 的
的![]() ,则所有含有固体MgCO3的溶液中,都有
,则所有含有固体MgCO3的溶液中,都有![]() ,且
,且![]()
C.可通过比较![]() 和
和![]() 的Ksp的大小比较它们的溶解性
的Ksp的大小比较它们的溶解性
D.25 ℃时![]() ,故新生成的 AgCl可转化为AgI
,故新生成的 AgCl可转化为AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 已知甲烷的燃烧热为890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJmol-1
B. 已知强酸和强碱的稀溶液反应的中和热为57.3 kJmol-1,则CH3COOH+OH—=CH3COO—+H2O ΔH=-57.3 kJmol-1
C. 一定条件下,将0.5mol N2和1.5mol H2置于密闭容器中,充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJmol-1
2NH3(g) ΔH=-38.6 kJmol-1
D. 已知1g N2H4(l)和足量H2O2(l)反应生成氮气和水蒸气,放出热量20.05kJ,该热化学方程式可表示为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-641.6 kJmol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com