
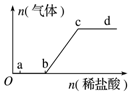
 向Na2CO3、NaHCO3混合溶液中逐滴滴入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴滴入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Al3+、H+、SO42-、NO3- | |
| B. | b点对应的溶液中:Ca2+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:F-、NO3-、Fe3+、Na+ |
分析 Na2CO3、NaHCO3,a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性,结合对应离子的性质解答该题.
解答 解:向Na2CO3、NaHCO3,a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性,
A.a点溶液中含有CO32-和HCO3-,与Al3+、H+反应不能大量共存,故A错误;
B.b点全部为HCO3-,Ca2+、OH-与HCO3-发生生成沉淀而不能大量共存,故B错误;
C.c点恰好完全反应生成NaCl,溶液呈中性,离子之间不发生任何反应,可大量共存,故C正确;
D.d点呈酸性,酸性条件下,F-在酸性条件下不能大量共存,故D错误.
故选C.
点评 本题考查离子共存问题,为高考常见题型,侧重于元素化合物知识的综合考查和学生的分析能力、审题的能力的考查,注意把握常见离子的性质以及反应类型的判断,答题时注意题中各阶段溶液的成分,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 立即关闭煤气阀门 | B. | 立即打开排风扇 | ||
| C. | 立即在家打电话通知煤气管理所 | D. | 用明火查找漏气部位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液$\stackrel{+NaOH溶液}{→}$生成蓝色沉淀,说明原溶液中有Cu2+ | |
| C. | 某溶液$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,说明原溶液中有SO42- | |
| D. | 某溶液$\stackrel{+KOH溶液}{→}$生成红褐色沉淀,说明原溶液中有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有②③④ | C. | 只有①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/LNa2CO3溶液:c(Na+)=2c(H2CO3)+2 c(HCO3-)+c(CO32?) | |
| B. | 能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 | |
| C. | 任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 将0.2 mol•L-1的HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
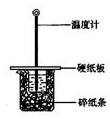 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com